Brownovo odkritje.
Škotski botanik Robert Brown (včasih se njegov priimek prepisuje kot Brown) je za časa svojega življenja kot najboljši poznavalec rastlin prejel naziv "Princ botanikov". Našel je veliko čudovitih odkritij. Leta 1805 je po štiriletni ekspediciji v Avstralijo v Anglijo prinesel približno 4000 znanstvenikom neznanih vrst avstralskih rastlin in jih več let preučeval. Opisane rastline, prinesene iz Indonezije in Srednje Afrike. Preučeval je fiziologijo rastlin in prvič podrobno opisal jedro rastlinske celice. Sanktpeterburška akademija znanosti ga je imenovala za častnega člana. Toda ime znanstvenika je zdaj splošno znano ne zaradi teh del.
Leta 1827 je Brown izvedel raziskavo cvetnega prahu rastlin. Zanimalo ga je predvsem, kako cvetni prah sodeluje pri oploditvi. Nekoč je pod mikroskopom preiskoval podolgovata citoplazemska zrna, suspendirana v vodi iz celic cvetnega prahu severnoameriške rastline Clarkia pulchella. Nenadoma je Brown videl, da najmanjša trdna zrna, ki jih je bilo komaj videti v kapljici vode, neprestano trepetajo in se premikajo z mesta na mesto. Ugotovil je, da ta gibanja po njegovih besedah »niso povezana niti s tokovi v tekočini niti z njenim postopnim izhlapevanjem, temveč so lastna delcem samim«.
Brownovo opažanje so potrdili tudi drugi znanstveniki. Najmanjši delci so se obnašali kot živi, "ples" delcev pa se je pospeševal z naraščanjem temperature in zmanjševanjem velikosti delcev ter očitno upočasnjeval pri zamenjavi vode z bolj viskoznim medijem. Ta osupljivi pojav se ni nikoli ustavil: opazovali so ga lahko poljubno dolgo. Brown je sprva celo mislil, da so v polje mikroskopa res padla živa bitja, še posebej, ker je cvetni prah moške reproduktivne celice rastlin, a tam so bili tudi delci odmrlih rastlin, tudi tistih, posušenih pred sto leti v herbariju. Tedaj se je Brown spraševal, ali so to »elementarne molekule živih bitij«, o katerih je govoril slavni francoski naravoslovec Georges Buffon (1707–1788), avtor 36-delne Naravoslovja. Ta predpostavka je odpadla, ko je Brown začel preiskovati očitno nežive predmete; sprva so bili zelo majhni delci premoga, pa tudi saje in prah iz londonskega zraka, nato fino zmlete anorganske snovi: steklo, številni različni minerali. »Aktivne molekule« so bile povsod: »V vsakem mineralu,« je zapisal Brown, »ki mi ga je uspelo zdrobiti v prah do te mere, da ga lahko nekaj časa suspendiramo v vodi, sem v večji ali manjši količini našel te molekule. ."
Povedati je treba, da Brown ni imel nobenega najnovejšega mikroskopa. V članku posebej poudarja, da je imel navadne bikonveksne leče, ki jih je uporabljal več let. In nadaljuje: »Skozi celotno študijo sem še naprej uporabljal iste leče, s katerimi sem začel delo, da bi svojim izjavam dal več verodostojnosti in jih naredil čim bolj dostopne običajnim opazovanjem.«
Zdaj, če ponovimo Brownovo opažanje, je dovolj imeti ne preveč močan mikroskop in z njim pregledati dim v zatemnjeni škatli, osvetljen skozi stransko luknjo s snopom močne svetlobe. V plinu se pojav manifestira veliko jasneje kot v tekočini: vidni so majhni koščki pepela ali saj (odvisno od vira dima), ki sipajo svetlobo in nenehno skačejo naprej in nazaj.
Kot se pogosto zgodi v znanosti, so mnogo let kasneje zgodovinarji odkrili, da je davnega leta 1670 izumitelj mikroskopa, Nizozemec Antonie Leeuwenhoek, očitno opazil podoben pojav, a redkost in nepopolnost mikroskopov, embrionalno stanje molekularne znanosti v tistem času Leeuwenhoekovo opazovanje ni vzbudilo pozornosti, zato odkritje upravičeno pripisujemo Brownu, ki ga je prvi podrobno preučil in opisal.
Brownovo gibanje in atomsko-molekularna teorija.
Pojav, ki ga je opazil Brown, je hitro postal splošno znan. Sam je svoje poskuse pokazal številnim kolegom (Brown našteje dva ducata imen). Toda niti sam Brown niti mnogi drugi znanstveniki dolga leta niso mogli razložiti tega skrivnostnega pojava, ki so ga poimenovali "Brownovo gibanje". Gibanje delcev je bilo popolnoma naključno: skice njihovih položajev, narejene v različnih časovnih točkah (na primer vsako minuto), na prvi pogled niso omogočile najti nobenega vzorca v teh gibanjih.
Razlaga Brownovega gibanja (kot so ta pojav poimenovali) z gibanjem nevidnih molekul je bila dana šele v zadnji četrtini 19. stoletja, vendar je vsi znanstveniki niso takoj sprejeli. Leta 1863 je učitelj deskriptivne geometrije iz Karlsruheja (Nemčija), Ludwig Christian Wiener (1826–1896), predlagal, da je pojav povezan z nihajnimi gibi nevidnih atomov. To je bila prva, čeprav zelo daleč od sodobne razlage Brownovega gibanja z lastnostmi samih atomov in molekul. Pomembno je, da je Wiener videl priložnost, da s tem pojavom prodre v skrivnosti strukture snovi. Bil je prvi, ki je poskušal izmeriti hitrost gibanja Brownovih delcev in njeno odvisnost od njihove velikosti. Zanimivo je, da je bilo leta 1921 v Proceedings of the National Academy of Sciences Združenih držav objavljeno delo o Brownovem gibanju drugega Wienerja, Norberta, slavnega ustanovitelja kibernetike.
Ideje L. K. Wienerja so sprejeli in razvijali številni znanstveniki - Sigmund Exner v Avstriji (in 33 let kasneje - njegov sin Felix), Giovanni Cantoni v Italiji, Karl Wilhelm Negeli v Nemčiji, Louis Georges Gouy v Franciji, trije belgijski duhovniki. - Jezuiti Carbonelli, Delso in Tirion ter drugi. Med temi znanstveniki je bil pozneje slavni angleški fizik in kemik William Ramsay. Postopoma je postalo jasno, da na najmanjša zrnca snovi z vseh strani udarjajo še manjši delci, ki jih skozi mikroskop ne vidimo več – tako kot valovi, ki zibljejo oddaljeno barko, niso vidni z obale, medtem ko se premikanje barke ne vidi več. same so precej jasno vidne. Kot so zapisali v enem od člankov leta 1877, »...zakon velikih števil ne reducira več učinka trkov na povprečni enotni tlak; njihova rezultanta ne bo več enaka nič, ampak bo nenehno spreminjala svojo smer in velikost.”
Kakovostno je bila slika precej verjetna in celo vizualna. Majhna vejica ali žuželka, ki jo številne mravlje potiskajo (ali vlečejo) v različne smeri, bi se morala premikati približno enako. Ti manjši delci so bili pravzaprav v besednjaku znanstvenikov, vendar jih nihče ni nikoli videl. Imenovali so jih molekule; V prevodu iz latinščine ta beseda pomeni "majhna masa". Presenetljivo je, da je natanko to razlago podobnemu pojavu podal rimski filozof Titus Lucretius Carus (ok. 99–55 pr. n. št.) v svoji znameniti pesmi O naravi stvari. V njem najmanjše delce, očem nevidne, imenuje »prvotni principi« stvari.
Načela stvari se najprej premikajo sama,
Sledijo jim telesa iz njihove najmanjše kombinacije,
Po moči tako rekoč blizu primarnim načelom,
Skriti pred njimi, deležni šokov, si začnejo prizadevati,
Sami, da se premaknejo, nato pa spodbujajo večja telesa.
Torej, začenši od začetka, gibanje malo po malo
Dotakne se naših občutkov in postane tudi vidno
Za nas in v drobcih prahu, ki se premikajo v sončni svetlobi,
Čeprav so tresljaji, iz katerih nastane, neopazni ...
Kasneje se je izkazalo, da se je Lukrecij motil: Brownovega gibanja je nemogoče opazovati s prostim očesom in prašni delci v sončnem žarku, ki je prodrl v temno sobo, "plešejo" zaradi vrtinčnih gibanj zraka. Toda navzven imata oba pojava nekaj podobnosti. In šele v 19. stoletju. Mnogim znanstvenikom je postalo očitno, da gibanje Brownovih delcev povzročajo naključni udarci molekul medija. Gibajoče se molekule trčijo ob delce prahu in druge trdne delce, ki so v vodi. Višja kot je temperatura, hitrejše je gibanje. Če je drobec prahu velik, ima na primer velikost 0,1 mm (premer je milijonkrat večji od premera molekule vode), potem so številni hkratni udarci nanj z vseh strani medsebojno uravnoteženi in praktično ni "Občutite" jih - približno enako kot kos lesa velikosti krožnika ne bo "občutil" napora številnih mravelj, ki ga bodo vlekle ali potiskale v različne smeri. Če je prašni delec relativno majhen, se bo pod vplivom udarcev okoliških molekul premaknil v eno ali drugo smer.
Brownovi delci imajo velikost reda 0,1–1 μm, tj. od tisočinke do desettisočinke milimetra, zato je Brown lahko razločil njihovo gibanje, saj je gledal drobna citoplazemska zrnca in ne sam cvetni prah (o čemer se pogosto zmotno piše). Težava je v prevelikih celicah cvetnega prahu. Tako je pri cvetnem prahu travniških trav, ki ga prenaša veter in povzroča alergijske bolezni pri ljudeh (seneni nahod), velikost celic običajno v območju 20 - 50 mikronov, tj. so preveliki za opazovanje Brownovega gibanja. Pomembno je tudi omeniti, da se posamezna gibanja Brownovega delca pojavljajo zelo pogosto in na zelo kratkih razdaljah, tako da jih ni mogoče videti, pod mikroskopom pa so vidna gibanja, ki so se zgodila v določenem časovnem obdobju.
Zdi se, da je že samo dejstvo obstoja Brownovega gibanja nedvoumno dokazovalo molekularno strukturo snovi, a že na začetku 20. st. Bili so znanstveniki, vključno s fiziki in kemiki, ki niso verjeli v obstoj molekul. Atomsko-molekularna teorija se je le počasi in s težavo uveljavljala. Tako je vodilni francoski organski kemik Marcelin Berthelot (1827–1907) zapisal: »Pojem molekule je z vidika našega znanja negotov, medtem ko je drug pojem - atom - povsem hipotetičen.« Slavni francoski kemik A. Saint-Clair Deville (1818–1881) je spregovoril še jasneje: »Ne sprejemam Avogadrovega zakona, niti atoma, niti molekule, ker nočem verjeti v tisto, česar ne morem niti videti niti opazovati. ” In nemški fizikalni kemik Wilhelm Ostwald (1853–1932), Nobelov nagrajenec, eden od utemeljiteljev fizikalne kemije, že v začetku 20. stoletja. odločno zanikal obstoj atomov. Uspelo mu je napisati kemijski učbenik v treh zvezkih, v katerem beseda "atom" sploh ni omenjena. Ostwald je 19. aprila 1904 z velikim poročilom na Kraljevi ustanovi pred člani Angleškega kemijskega društva poskušal dokazati, da atomi ne obstajajo in da je »to, čemur pravimo materija, le skupek energij, zbranih skupaj v danem mesto.”
Toda tudi tisti fiziki, ki so sprejeli molekularno teorijo, niso mogli verjeti, da je bila veljavnost atomsko-molekularne teorije dokazana na tako preprost način, zato so bili za razlago pojava predstavljeni različni alternativni razlogi. In to je povsem v duhu znanosti: dokler vzrok nekega pojava ni nedvoumno ugotovljen, je mogoče (in celo potrebno) postavljati različne hipoteze, ki jih je treba po možnosti preizkusiti eksperimentalno ali teoretično. Tako je bil leta 1905 v Enciklopedičnem slovarju Brockhaus in Efron objavljen kratek članek profesorja fizike iz Sankt Peterburga N. A. Gezehusa, učitelja slavnega akademika A. F. Ioffeja. Gesehus je zapisal, da po mnenju nekaterih znanstvenikov Brownovo gibanje povzročajo »svetlobni ali toplotni žarki, ki prehajajo skozi tekočino«, in se skrči na »preproste tokove znotraj tekočine, ki nimajo nobene zveze z gibanjem molekul« in ti tokovi lahko povzroči "izhlapevanje, difuzija in drugi razlogi." Navsezadnje je bilo že znano, da zelo podobno gibanje prašnih delcev v zraku povzročajo ravno vrtinčni tokovi. Toda razlago, ki jo je dal Gesehus, bi zlahka eksperimentalno ovrgli: če skozi močan mikroskop pogledate dva Brownova delca, ki se nahajata zelo blizu drug drugega, se bo izkazalo, da sta njuna gibanja popolnoma neodvisna. Če bi ta gibanja povzročili kakršni koli tokovi v tekočini, bi se takšni sosednji delci gibali usklajeno.
Teorija Brownovega gibanja.
V začetku 20. stol. večina znanstvenikov je razumela molekularno naravo Brownovega gibanja. Toda vse razlage so ostale zgolj kvalitativne; nobena kvantitativna teorija ni zdržala eksperimentalnega testiranja. Poleg tega so bili sami eksperimentalni rezultati nejasni: fantastičen spektakel neprekinjenih drvečih delcev je hipnotiziral eksperimentatorje in niso natančno vedeli, katere značilnosti pojava je treba izmeriti.
Kljub navidezni popolni neurejenosti je bilo še vedno mogoče opisati naključna gibanja Brownovih delcev z matematičnim odnosom. Prvič je strogo razlago Brownovega gibanja leta 1904 podal poljski fizik Marian Smoluchowski (1872–1917), ki je v tistih letih delal na univerzi v Lvivu. Istočasno je teorijo tega pojava razvil Albert Einstein (1879–1955), takrat malo znani strokovnjak 2. razreda na patentnem uradu švicarskega mesta Bern. Njegov članek, objavljen maja 1905 v nemški reviji Annalen der Physik, je bil naslovljen O gibanju delcev, suspendiranih v tekočini v mirovanju, ki ga zahteva molekularna kinetična teorija toplote. S tem imenom je želel Einstein pokazati, da molekularno kinetična teorija zgradbe snovi nujno implicira obstoj naključnega gibanja najmanjših trdnih delcev v tekočinah.
Nenavadno je, da Einstein na samem začetku tega članka piše, da je seznanjen s samim pojavom, čeprav površno: »Možno je, da so obravnavana gibanja identična s tako imenovanim Brownovim molekularnim gibanjem, vendar razpoložljivi podatki so zame v zvezi s slednjimi tako netočni, da si nisem mogel oblikovati dokončnega mnenja.« In desetletja kasneje, že v poznem življenju, je Einstein v svojih spominih zapisal nekaj drugega – da Brownovega gibanja sploh ni vedel in ga je pravzaprav »ponovno odkril« zgolj teoretično: »Ne vedoč, da so opazovanja »Brownovega gibanja« že dolgo znano, odkril sem, da atomska teorija vodi v obstoj opazljivega gibanja mikroskopskih suspendiranih delcev.« Kakor koli že, Einsteinov teoretični članek se je končal z neposrednim pozivom eksperimentatorjem, naj eksperimentalno preizkusijo njegove zaključke: »Če bi lahko kateri koli raziskovalec kmalu odgovoril vprašanja, postavljena tukaj, vprašanja!" – s tako nenavadnim vzklikom konča svoj članek.
Odgovor na Einsteinov strasten poziv ni čakal dolgo.
Po teoriji Smoluchowski-Einstein je povprečna vrednost kvadrata premika Brownovega delca (s2) v času t premo sorazmerna s temperaturo T in obratno sorazmerna z viskoznostjo tekočine h, velikostjo delcev r in Avogadrovo konstanto
NA: s2 = 2RTt/6phrNA,
Kjer je R plinska konstanta. Torej, če se v 1 minuti delec s premerom 1 μm premakne za 10 μm, se v 9 minutah premakne za 10 = 30 μm, v 25 minutah - za 10 = 50 μm itd. Pod podobnimi pogoji se bo delec s premerom 0,25 μm v enakih časovnih obdobjih (1, 9 in 25 min) premaknil za 20, 60 oziroma 100 μm, saj je = 2. Pomembno je, da zgornja formula vključuje Avogadrovo konstanto, ki je torej , lahko določimo s kvantitativnimi meritvami gibanja Brownovega delca, ki jih je opravil francoski fizik Jean Baptiste Perrin (1870–1942).
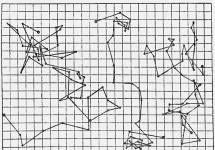
Leta 1908 je Perrin začel s kvantitativnimi opazovanji gibanja Brownovih delcev pod mikroskopom. Uporabil je ultramikroskop, izumljen leta 1902, ki je omogočal zaznavanje najmanjših delcev tako, da je nanje razpršil svetlobo iz močnega stranskega osvetljevalca. Perrin je iz gumija, zgoščenega soka nekaterih tropskih dreves (uporablja se tudi kot rumena akvarelna barva), pridobil drobne kroglice skoraj sferične oblike in približno enake velikosti. Te drobne kroglice so bile suspendirane v glicerolu, ki je vseboval 12 % vode; viskozna tekočina je preprečila pojav notranjih tokov v njej, ki bi zameglili sliko. Oborožen s štoparico, je Perrin zabeležil in nato skiciral (seveda v močno povečanem merilu) na list papirja z grafom položaj delcev v rednih intervalih, na primer vsake pol minute. S povezovanjem nastalih točk z ravnimi črtami je dobil zapletene trajektorije, od katerih so nekatere prikazane na sliki (povzete so iz Perrinove knjige Atomy, izdane leta 1920 v Parizu). Tako kaotično, neurejeno gibanje delcev vodi do dejstva, da se premikajo v prostoru precej počasi: vsota segmentov je veliko večja od premika delca od prve točke do zadnje. 
Zaporedni položaji vsakih 30 sekund treh Brownovih delcev - žvečilnih kroglic velikosti približno 1 mikrona. Ena celica ustreza razdalji 3 µm.
Zaporedni položaji vsakih 30 sekund treh Brownovih delcev - žvečilnih kroglic velikosti približno 1 mikrona. Ena celica ustreza razdalji 3 µm. Če bi Perrin lahko določil položaj Brownovih delcev ne po 30, temveč po 3 sekundah, bi se ravne črte med vsakimi sosednjimi točkami spremenile v enako zapleteno cik-cak zlomljeno črto, le v manjšem merilu.
S pomočjo teoretične formule in svojih rezultatov je Perrin dobil dokaj natančno vrednost Avogadrovega števila za tisti čas: 6.8.1023. Perrin je uporabil tudi mikroskop za preučevanje navpične porazdelitve Brownovih delcev (glej AVOGADROV ZAKON) in pokazal, da kljub delovanju gravitacije ostanejo suspendirani v raztopini. Perrin ima tudi druga pomembna dela. Leta 1895 je dokazal, da so katodni žarki negativni električni naboji (elektroni), leta 1901 pa je prvi predlagal planetarni model atoma. Leta 1926 je prejel Nobelovo nagrado za fiziko.
Rezultati, ki jih je dobil Perrin, so potrdili Einsteinove teoretične zaključke. To je naredilo močan vtis. Kot je mnogo let kasneje zapisal ameriški fizik A. Pais, »nikoli ne nehate biti presenečeni nad tem rezultatom, pridobljenim na tako preprost način: dovolj je, da pripravite suspenzijo kroglic, katerih velikost je velika v primerjavi z velikostjo preprostih molekul, vzemite štoparico in mikroskop in lahko določite Avogadrovo konstanto!« Lahko bi bili tudi presenečeni: opisi novih poskusov Brownovega gibanja se občasno še vedno pojavljajo v znanstvenih revijah (Nature, Science, Journal of Chemical Education)! Po objavi Perrinovih rezultatov je Ostwald, nekdanji nasprotnik atomizma, priznal, da »sovpadanje Brownovega gibanja z zahtevami kinetične hipoteze ... zdaj daje najbolj previdnemu znanstveniku pravico, da govori o eksperimentalnem dokazu atomske teorije. snovi. Tako je bila atomska teorija povzdignjena v rang znanstvene, dobro utemeljene teorije.” Ponavlja ga francoski matematik in fizik Henri Poincaré: »Briljantna Perrinova določitev števila atomov je dopolnila zmagoslavje atomizma ... Atom kemikov je zdaj postal resničnost.«
Brownovo gibanje in difuzija.
Gibanje Brownovih delcev je po videzu zelo podobno gibanju posameznih molekul zaradi njihovega toplotnega gibanja. To gibanje imenujemo difuzija. Še pred delom Smoluchowskega in Einsteina so bili ugotovljeni zakoni gibanja molekul v najpreprostejšem primeru plinastega stanja snovi. Izkazalo se je, da se molekule v plinih premikajo zelo hitro – s hitrostjo naboja, ne morejo pa leteti daleč, saj zelo pogosto trčijo z drugimi molekulami. Na primer, molekule kisika in dušika v zraku, ki se gibljejo s povprečno hitrostjo približno 500 m/s, vsako sekundo doživijo več kot milijardo trkov. Zato bi bila pot molekule, če bi ji bilo mogoče slediti, kompleksna lomljena črta. Brownovi delci prav tako opisujejo podobno trajektorijo, če je njihov položaj zabeležen v določenih časovnih intervalih. Tako difuzija kot Brownovo gibanje sta posledica kaotičnega toplotnega gibanja molekul in ju zato opisujejo podobni matematični odnosi. Razlika je v tem, da se molekule v plinih gibljejo premočrtno, dokler ne trčijo z drugimi molekulami, nato pa spremenijo smer. Brownov delec, za razliko od molekule, ne izvaja nobenih "prostih letov", ampak doživlja zelo pogoste majhne in neenakomerne "trepetaje", zaradi katerih se kaotično premika v eno ali drugo smer. Izračuni so pokazali, da se pri delcu velikosti 0,1 µm en premik zgodi v treh milijardah sekunde na razdalji le 0,5 nm (1 nm = 0,001 µm). Kot je primerno rekel neki avtor, to spominja na premikanje prazne pločevinke piva na trgu, kjer se je zbrala množica ljudi.
Difuzijo je veliko lažje opazovati kot Brownovo gibanje, saj ne potrebuje mikroskopa: gibanja ne opazujemo posameznih delcev, temveč njihovih ogromnih mas, zagotoviti morate le, da difuzije ne prekriva konvekcija – mešanje snovi kot posledica vrtinčnih tokov (takšne tokove zlahka opazimo, če v kozarec vroče vode kanemo kapljico obarvane raztopine, na primer črnila).
Difuzijo je priročno opazovati v gostih gelih. Takšen gel lahko pripravimo na primer v kozarcu za penicilin, tako da v njem pripravimo 4–5 % raztopino želatine. Želatina mora najprej nekaj ur nabrekniti, nato pa jo ob mešanju povsem raztopimo tako, da kozarec spustimo v vrelo vodo. Po ohlajanju dobimo netekoč gel v obliki prozorne, rahlo motne mase. Če z ostro pinceto v sredino te mase previdno vstavite kristalček kalijevega permanganata (»kalijev permanganat«), bo kristal ostal viseti na mestu, kjer je ostal, saj gel preprečuje, da bi padel. V nekaj minutah bo okoli kristala začela rasti vijolična kroglica, ki bo sčasoma postajala vse večja in večja, dokler stene kozarca ne popačijo njene oblike. Enak rezultat lahko dosežemo s kristalom bakrovega sulfata, le v tem primeru krogla ne bo vijolična, ampak modra.
Jasno je, zakaj se je krogla obrnila: ioni MnO4–, ki nastanejo med raztapljanjem kristala, gredo v raztopino (gel je večinoma voda) in se zaradi difuzije gibljejo enakomerno v vse smeri, gravitacija pa praktično ne vpliva. na hitrost difuzije. Difuzija v tekočini je zelo počasna: trajalo bo več ur, da kroglica zraste nekaj centimetrov. Pri plinih je difuzija veliko hitrejša, a vseeno, če zrak ne bi bil mešan, bi se vonj po parfumu ali amoniaku širil po prostoru ure in ure.
Brownova teorija gibanja: naključni sprehodi.
Smoluchowski-Einsteinova teorija pojasnjuje zakone tako difuzije kot Brownovega gibanja. Te vzorce lahko obravnavamo na primeru difuzije. Če je hitrost molekule u, potem bo pri gibanju premočrtno pretekla razdaljo L = ut v času t, vendar se ta molekula zaradi trkov z drugimi molekulami ne giblje premočrtno, ampak se nenehno spreminja smer njegovega gibanja. Če bi bilo mogoče skicirati pot molekule, se v osnovi ne bi razlikovala od risb, ki jih je dobil Perrin. Iz takšnih slik je razvidno, da se molekula zaradi kaotičnega gibanja premakne za razdaljo s, bistveno manjšo od L. Ti količini sta povezani z razmerjem s =, kjer je l razdalja, ki jo molekula preleti od enega trka do druga, povprečna prosta pot. Meritve so pokazale, da je za molekule zraka pri normalnem atmosferskem tlaku l ~ 0,1 μm, kar pomeni, da bo pri hitrosti 500 m/s molekula dušika ali kisika preletela v 10.000 sekundah (manj kot tri ure) razdaljo L = 5000 km in bo premik od prvotnega položaja le s = 0,7 m (70 cm), zato se snovi zaradi difuzije premikajo tako počasi, tudi v plinih.
Pot molekule kot posledica difuzije (ali pot Brownovega delca) imenujemo naključni sprehod. Duhoviti fiziki so ta izraz reinterpretirali kot pijanec hojo - "pot pijanca." Dejansko gibanje delca iz enega položaja v drugega (ali pot molekule, ki je podvržena številnim trkom) spominja na gibanje pijanega človeka. Še več, ta analogija omogoča tudi precej preprosto izpeljavo osnovne enačbe takega procesa, ki temelji na primeru enodimenzionalnega gibanja, ki ga je enostavno posplošiti na tridimenzionalno.
Recimo, da je pijani mornar pozno zvečer prišel iz gostilne in se napotil po ulici. Ko je prehodil pot l do najbližje svetilke, si je odpočil in šel ... ali naprej, do naslednje svetilke, ali nazaj, v gostilno - navsezadnje se ne spomni, od kod je prišel. Vprašanje pa je, ali bo kdaj zapustil bučko, ali bo le taval okoli nje, se ji zdaj odmikal, zdaj približeval? (Druga različica problema navaja, da so na obeh koncih ulice umazani jarki, kjer se končajo ulične luči, in sprašuje, ali se bo mornar lahko izognil padcu v enega od njih.) Intuitivno se zdi, da je drugi odgovor pravilen. Vendar je napačno: izkaže se, da se bo mornar postopoma vedno bolj oddaljeval od ničelne točke, čeprav veliko počasneje, kot če bi hodil samo v eno smer. Evo, kako to dokazati.
Ko se mornar prvič sprehodi do najbližje luči (desno ali levo), se znajde na razdalji s1 = ± l od začetne točke. Ker nas zanima le njegova oddaljenost od te točke, ne pa tudi smer, se bomo predznakov znebili s kvadriranjem tega izraza: s12 = l2. Čez nekaj časa bo mornar, ki je že opravil N "potepanj", oddaljen
SN = od začetka. In po ponovnem prehodu (v eno smer) do najbližje svetilke, na razdalji sN+1 = sN ± l, ali z uporabo kvadrata pomika, s2N+1 = s2N ±2sN l + l2. Če jadralec večkrat ponovi to gibanje (od N do N + 1), potem se bo zaradi povprečenja (z enako verjetnostjo naredi N-ti korak v desno ali v levo) izraz ±2sNl zmanjšal, torej to (kotni oklepaji označujejo povprečno vrednost).
Ker je s12 = l2, potem
S22 = s12 + l2 = 2l2, s32 = s22 + l2 = 3ll2 itd., tj. s2N = Nl2 ali sN =l. Skupno prevoženo razdaljo L lahko zapišemo kot zmnožek mornarjeve hitrosti in časa potovanja (L = ut) ter kot zmnožek števila tavanj in razdalje med lučmi (L = Nl), torej ut = Nl, od koder je N = ut/l in končno sN = . Tako dobimo odvisnost premika mornarja (pa tudi molekule oz. Brownovega delca) od časa. Na primer, če je med lučmi 10 m in mornar hodi s hitrostjo 1 m/s, bo v eni uri njegova skupna pot L = 3600 m = 3,6 km, medtem ko bo premik od ničelne točke med isti čas bo le s = = 190 m V treh urah bo prevozil L = 10,8 km in se premaknil za s = 330 m itd.
Produkt ul v dobljeni formuli lahko primerjamo z difuzijskim koeficientom, ki je, kot je pokazal irski fizik in matematik George Gabriel Stokes (1819–1903), odvisen od velikosti delcev in viskoznosti medija. Na podlagi podobnih razmišljanj je Einstein izpeljal svojo enačbo.
Teorija Brownovega gibanja v resničnem življenju.
Teorija naključnih sprehodov ima pomembno praktično uporabo. Pravijo, da človek v odsotnosti orientacijskih točk (sonca, zvezd, hrupa avtoceste ali železnice itd.) tava v gozdu, po polju v snežnem metežu ali v gosti megli v krogih in se vedno vrača k svojemu izvirno mesto. Pravzaprav ne hodi v krogu, ampak približno tako, kot se gibljejo molekule oziroma Brownovi delci. Lahko se vrne na prvotno mesto, vendar le po naključju. A velikokrat mu prekriža pot. Pravijo tudi, da so ljudi, zmrznjene v snežnem metežu, našli "nekaj kilometra" od najbližjega stanovanja ali ceste, v resnici pa oseba ni imela možnosti, da bi ta kilometer prehodila, in tukaj je razlog.
Če želite izračunati, koliko se bo oseba premaknila zaradi naključnih sprehodov, morate poznati vrednost l, tj. razdalja, ki jo človek lahko prehodi v ravni črti brez orientacijskih točk. To vrednost je izmeril doktor geoloških in mineraloških znanosti B. S. Gorobets s pomočjo študentov prostovoljcev. Seveda jih ni pustil v gostem gozdu ali na zasneženem igrišču, vse je bilo bolj preprosto - študenta so postavili na sredino praznega stadiona, mu zavezali oči in ga prosili, naj hodi do konca nogometnega igrišča v popolna tišina (za izključitev orientacije po zvokih). Izkazalo se je, da je učenec v povprečju hodil po ravni črti le približno 20 metrov (odstopanje od idealne ravnine ni presegalo 5°), nato pa je začel vse bolj odstopati od prvotne smeri. Na koncu se je ustavil, daleč od tega, da bi dosegel rob.
Naj zdaj človek hodi (oziroma tava) po gozdu s hitrostjo 2 kilometra na uro (za cesto je to zelo počasi, za gost gozd pa zelo hitro), potem če je vrednost l 20 metrov, potem bo v eni uri pretekel 2 km, vendar se bo premaknil le 200 m, v dveh urah - približno 280 m, v treh urah - 350 m, v 4 urah - 400 m itd. In premikanje v ravni črti na s takšno hitrostjo bi človek prehodil 8 kilometrov v 4 urah, zato je v varnostnih navodilih za terensko delo naslednje pravilo: če se mejniki izgubijo, morate ostati na mestu, postaviti zavetje in počakati na konec slabega vremena (lahko posije sonce) ali po pomoč. V gozdu vam bodo mejniki - drevesa ali grmičevje - pomagali premikati v ravni črti in vsakič se morate držati dveh takih mejnikov - enega spredaj, drugega zadaj. Seveda pa je najbolje vzeti s seboj kompas ...
Kaj je Brownovo gibanje?
Sedaj se boste seznanili z najočitnejšim dokazom toplotnega gibanja molekul (drugo glavno stališče molekularne kinetične teorije). Bodite prepričani, da poskusite pogledati skozi mikroskop in videti, kako se premikajo tako imenovani Brownovi delci.
Prej ste se naučili, kaj je to difuzijo, tj. mešanje plinov, tekočin in trdnih snovi v neposrednem stiku. Ta pojav je mogoče pojasniti z naključnim gibanjem molekul in prodiranjem molekul ene snovi v prostor med molekulami druge snovi. To lahko pojasni na primer dejstvo, da je prostornina mešanice vode in alkohola manjša od prostornine njenih sestavnih delov. Toda najočitnejši dokaz gibanja molekul lahko dobimo z opazovanjem najmanjših delcev katere koli trdne snovi, suspendirane v vodi, skozi mikroskop. Ti delci so podvrženi naključnemu gibanju, ki se imenuje brownovsko.
To je toplotno gibanje delcev, suspendiranih v tekočini (ali plinu).
Opazovanje Brownovega gibanja
Angleški botanik R. Brown (1773-1858) je ta pojav prvič opazil leta 1827, ko je pod mikroskopom preiskoval spore mahu, suspendirane v vodi. Kasneje je pogledal še druge majhne delce, vključno z delci kamna iz egiptovskih piramid. Dandanes za opazovanje Brownovega gibanja uporabljajo delce gumene barve, ki je netopna v vodi. Ti delci se gibljejo naključno. Najbolj neverjetno in nenavadno za nas je, da se to gibanje nikoli ne ustavi. Navajeni smo, da se vsako premikajoče se telo prej ali slej ustavi. Brown je sprva mislil, da spore mahu kažejo znake življenja.
toplotno gibanje in se ne more ustaviti. Z zvišanjem temperature se njegova intenzivnost povečuje. Slika 8.3 prikazuje diagram gibanja Brownovih delcev. Položaje delcev, označenih s pikami, določamo v enakomernih intervalih po 30 s. Te točke so povezane z ravnimi črtami. V resnici je pot delcev veliko bolj zapletena.Brownovo gibanje lahko opazimo tudi v plinu. Povzročajo ga delci prahu ali dima, lebdeči v zraku.
Nemški fizik R. Pohl (1884-1976) slikovito opiše Brownovo gibanje: »Le malo pojavov je sposobnih tako očarati opazovalca kot Brownovo gibanje. Tukaj je opazovalcu omogočen pogled v zakulisje dogajanja v naravi. Pred njim se odpre nov svet - neprestani vrvež ogromnega števila delcev. Najmanjši delci hitro letijo skozi vidno polje mikroskopa in skoraj v trenutku spremenijo smer gibanja. Večji delci se gibljejo počasneje, a tudi nenehno spreminjajo smer gibanja. Veliki delci so praktično zdrobljeni na mestu. Njihove izbokline jasno prikazujejo vrtenje delcev okoli svoje osi, ki nenehno spreminja smer v prostoru. Nikjer ni sledi sistema ali reda. Prevlada slepega naključja – to je močan, izjemen vtis, ki ga ta slika naredi na opazovalca.”
Trenutno koncept Brownovo gibanje uporabljeno v širšem pomenu. Brownovo gibanje je na primer tresenje igel občutljivih merilnih instrumentov, ki nastane zaradi toplotnega gibanja atomov delov instrumenta in okolja.
Razlaga Brownovega gibanja
Brownovo gibanje je mogoče razložiti samo na podlagi molekularne kinetične teorije. Razlog za Brownovo gibanje delca je v tem, da se udarci tekočih molekul na delec med seboj ne izničijo.. Slika 8.4 shematično prikazuje položaj enega Brownovega delca in molekul, ki so mu najbližje. Ko se molekule gibljejo naključno, impulzi, ki jih posredujejo Brownovemu delcu, na primer v levo in desno, niso enaki. Zato je nastala sila pritiska molekul tekočine na Brownov delec različna od nič. Ta sila povzroči spremembo gibanja delca.

Povprečni tlak ima določeno vrednost tako v plinu kot v tekočini. Vendar vedno obstajajo manjša naključna odstopanja od tega povprečja. Manjša kot je površina telesa, bolj opazne so relativne spremembe sile pritiska, ki deluje na to območje. Torej, na primer, če je območje velikosti reda več premerov molekule, potem se sila pritiska, ki deluje nanj, nenadoma spremeni od nič do določene vrednosti, ko molekula zadene to območje.
Molekularno kinetično teorijo Brownovega gibanja je leta 1905 ustvaril A. Einstein (1879-1955).
Konstrukcija teorije Brownovega gibanja in njena eksperimentalna potrditev s strani francoskega fizika J. Perrina je dokončno dopolnila zmago molekularne kinetične teorije.
Perrinovi poskusi
Ideja Perrinovih poskusov je naslednja. Znano je, da koncentracija molekul plina v atmosferi pada z višino. Če toplotnega gibanja ne bi bilo, bi vse molekule padle na Zemljo in atmosfera bi izginila. Če pa ne bi bilo privlačnosti Zemlje, bi zaradi toplotnega gibanja molekule zapustile Zemljo, saj se plin lahko neomejeno širi. Zaradi delovanja teh nasprotujočih si dejavnikov se vzpostavi določena porazdelitev molekul po višini, kot je navedeno zgoraj, to je, da koncentracija molekul z višino precej hitro pada. Še več, večja ko je masa molekul, hitreje pada njihova koncentracija z višino.
Brownovi delci sodelujejo pri toplotnem gibanju. Ker je njihova interakcija zanemarljivo majhna, lahko zbiranje teh delcev v plinu ali tekočini obravnavamo kot idealen plin zelo težkih molekul. Posledično bi morala koncentracija Brownovih delcev v plinu ali tekočini v gravitacijskem polju Zemlje upadati po istem zakonu kot koncentracija molekul plina. Ta zakon je znan.
Perrin je z uporabo mikroskopa z veliko povečavo in majhno globinsko ostrino (shallow depth of field) opazoval Brownove delce v zelo tankih plasteh tekočine. Z izračunom koncentracije delcev na različnih višinah je ugotovil, da ta koncentracija pada z višino po isti zakonitosti kot koncentracija molekul plina. Razlika je v tem, da zaradi velike mase Brownovih delcev do zmanjšanja pride zelo hitro.
Še več, štetje Brownovih delcev na različnih višinah je Perrinu omogočilo določitev Avogadrove konstante s popolnoma novo metodo. Vrednost te konstante je sovpadala z znano.
Vsa ta dejstva kažejo na pravilnost teorije Brownovega gibanja in s tem na to, da Brownovi delci sodelujejo pri toplotnem gibanju molekul.
Jasno ste videli obstoj toplotnega gibanja; videl kaotično gibanje. Molekule se gibljejo še bolj naključno kot Brownovi delci.
Bistvo pojava
Zdaj pa poskusimo razumeti bistvo pojava Brownovega gibanja. In to se zgodi, ker so vse absolutno tekočine in plini sestavljeni iz atomov ali molekul. Vemo pa tudi, da ti drobni delci, ki so v neprekinjenem kaotičnem gibanju, nenehno potiskajo Brownov delec iz različnih smeri.
Zanimivo pa je, da so znanstveniki dokazali, da delci večjih velikosti, ki presegajo 5 mikronov, ostanejo nepremični in skoraj ne sodelujejo pri Brownovem gibanju, česar pa ne moremo reči za manjše delce. Delci z velikostjo manjšo od 3 mikronov so sposobni translacijskega gibanja, izvajanja rotacije ali pisanja kompleksnih trajektorij.
Ko je veliko telo potopljeno v okolje, se zdi, da sunki, ki se pojavijo v ogromni količini, dosežejo povprečno raven in vzdržujejo stalen pritisk. V tem primeru pride v poštev Arhimedova teorija, saj veliko telo, ki je z vseh strani obdano z okoljem, uravnoteži pritisk in preostala dvižna sila omogoči temu telesu, da lebdi ali potone.
Če pa ima telo dimenzije, kot je Brownov delec, to je popolnoma neopazno, potem postanejo opazna odstopanja tlaka, ki prispevajo k ustvarjanju naključne sile, ki vodi do vibracij teh delcev. Sklepamo lahko, da so Brownovi delci v mediju v suspenziji, v nasprotju z velikimi delci, ki tonejo ali lebdijo.
Pomen Brownovega gibanja
Poskusimo ugotoviti, ali ima Brownovo gibanje kakšen pomen v naravnem okolju:
Prvič, Brownovo gibanje igra pomembno vlogo pri prehrani rastlin iz zemlje;
Drugič, v človeških in živalskih organizmih pride do absorpcije hranil skozi stene prebavnih organov zaradi Brownovega gibanja;
Tretjič, pri izvajanju kožnega dihanja;
In končno, Brownovo gibanje je pomembno pri porazdelitvi škodljivih snovi v zraku in vodi.
Domača naloga
Pozorno preberi vprašanja in nanje pisno odgovori:
1. Se spomnite, kaj se imenuje difuzija?
2. Kakšna je povezava med difuzijo in toplotnim gibanjem molekul?
3. Definirajte Brownovo gibanje.
4. Ali menite, da je Brownovo gibanje termično in utemeljite svoj odgovor?
5. Ali se narava Brownovega gibanja spremeni pri segrevanju? Če se spremeni, kako natančno?
6. Katera naprava se uporablja za preučevanje Brownovega gibanja?
7. Ali se vzorec Brownovega gibanja spreminja z naraščajočo temperaturo in kako natančno?
8. Ali bo prišlo do sprememb Brownovega gibanja, če vodno emulzijo zamenjamo z glicerolom?
G.Ya.Myakishev, B.B.Bukhovtsev, N.N.Sotsky, Fizika 10. razred
Škotski botanik Robert Brown (včasih se njegov priimek prepisuje kot Brown) je za časa svojega življenja kot najboljši poznavalec rastlin prejel naziv "Princ botanikov". Našel je veliko čudovitih odkritij. Leta 1805 je po štiriletni ekspediciji v Avstralijo v Anglijo prinesel približno 4000 znanstvenikom neznanih vrst avstralskih rastlin in jih več let preučeval. Opisane rastline, prinesene iz Indonezije in Srednje Afrike. Preučeval je fiziologijo rastlin in prvič podrobno opisal jedro rastlinske celice. Sanktpeterburška akademija znanosti ga je imenovala za častnega člana. Toda ime znanstvenika je zdaj splošno znano ne zaradi teh del.
Leta 1827 je Brown izvedel raziskavo cvetnega prahu rastlin. Zanimalo ga je predvsem, kako cvetni prah sodeluje pri oploditvi. Nekoč je pod mikroskopom opazoval celice cvetnega prahu severnoameriške rastline. Clarkia pulchella(pretty clarkia) podolgovata citoplazemska zrna, suspendirana v vodi. Nenadoma je Brown videl, da najmanjša trdna zrna, ki jih je bilo komaj videti v kapljici vode, neprestano trepetajo in se premikajo z mesta na mesto. Ugotovil je, da ta gibanja po njegovih besedah »niso povezana niti s tokovi v tekočini niti z njenim postopnim izhlapevanjem, temveč so lastna delcem samim«.
Brownovo opažanje so potrdili tudi drugi znanstveniki. Najmanjši delci so se obnašali kot živi, "ples" delcev pa se je pospeševal z naraščanjem temperature in zmanjševanjem velikosti delcev ter očitno upočasnjeval pri zamenjavi vode z bolj viskoznim medijem. Ta osupljivi pojav se ni nikoli ustavil: opazovali so ga lahko poljubno dolgo. Brown je sprva celo mislil, da so v polje mikroskopa res padla živa bitja, še posebej, ker je cvetni prah moške reproduktivne celice rastlin, a tam so bili tudi delci odmrlih rastlin, tudi tistih, posušenih pred sto leti v herbariju. Tedaj je Brown razmišljal, ali so to »elementarne molekule živih bitij«, o katerih je govoril slavni francoski naravoslovec Georges Buffon (1707–1788), avtor 36-delne knjige. Naravna zgodovina. Ta predpostavka je odpadla, ko je Brown začel preiskovati očitno nežive predmete; sprva so bili zelo majhni delci premoga, pa tudi saje in prah iz londonskega zraka, nato fino zmlete anorganske snovi: steklo, številni različni minerali. »Aktivne molekule« so bile povsod: »V vsakem mineralu,« je zapisal Brown, »ki mi ga je uspelo zdrobiti v prah do te mere, da ga lahko nekaj časa suspendiramo v vodi, sem v večji ali manjši količini našel te molekule. ."
Povedati je treba, da Brown ni imel nobenega najnovejšega mikroskopa. V članku posebej poudarja, da je imel navadne bikonveksne leče, ki jih je uporabljal več let. In nadaljuje: »Skozi celotno študijo sem še naprej uporabljal iste leče, s katerimi sem začel delo, da bi svojim izjavam dal več verodostojnosti in jih naredil čim bolj dostopne običajnim opazovanjem.«
Zdaj, če ponovimo Brownovo opažanje, je dovolj imeti ne preveč močan mikroskop in z njim pregledati dim v zatemnjeni škatli, osvetljen skozi stransko luknjo s snopom močne svetlobe. V plinu se pojav manifestira veliko jasneje kot v tekočini: vidni so majhni koščki pepela ali saj (odvisno od vira dima), ki sipajo svetlobo in nenehno skačejo naprej in nazaj.
Kot se pogosto zgodi v znanosti, so mnogo let kasneje zgodovinarji odkrili, da je davnega leta 1670 izumitelj mikroskopa, Nizozemec Antonie Leeuwenhoek, očitno opazil podoben pojav, a redkost in nepopolnost mikroskopov, embrionalno stanje molekularne znanosti v tistem času Leeuwenhoekovo opazovanje ni vzbudilo pozornosti, zato odkritje upravičeno pripisujemo Brownu, ki ga je prvi podrobno preučil in opisal.
Brownovo gibanje in atomsko-molekularna teorija.
Pojav, ki ga je opazil Brown, je hitro postal splošno znan. Sam je svoje poskuse pokazal številnim kolegom (Brown našteje dva ducata imen). Toda niti sam Brown niti mnogi drugi znanstveniki dolga leta niso mogli razložiti tega skrivnostnega pojava, ki so ga poimenovali "Brownovo gibanje". Gibanje delcev je bilo popolnoma naključno: skice njihovih položajev, narejene v različnih časovnih točkah (na primer vsako minuto), na prvi pogled niso omogočile najti nobenega vzorca v teh gibanjih.
Razlaga Brownovega gibanja (kot so ta pojav poimenovali) z gibanjem nevidnih molekul je bila dana šele v zadnji četrtini 19. stoletja, vendar je vsi znanstveniki niso takoj sprejeli. Leta 1863 je učitelj deskriptivne geometrije iz Karlsruheja (Nemčija), Ludwig Christian Wiener (1826–1896), predlagal, da je pojav povezan z nihajnimi gibi nevidnih atomov. To je bila prva, čeprav zelo daleč od sodobne razlage Brownovega gibanja z lastnostmi samih atomov in molekul. Pomembno je, da je Wiener videl priložnost, da s tem pojavom prodre v skrivnosti strukture snovi. Bil je prvi, ki je poskušal izmeriti hitrost gibanja Brownovih delcev in njeno odvisnost od njihove velikosti. Zanimivo je, da je leta 1921 Poročila Nacionalne akademije znanosti ZDA Izšlo je delo o Brownovem gibanju drugega Wienerja - Norberta, slavnega ustanovitelja kibernetike.
Ideje L. K. Wienerja so sprejeli in razvijali številni znanstveniki - Sigmund Exner v Avstriji (in 33 let kasneje - njegov sin Felix), Giovanni Cantoni v Italiji, Karl Wilhelm Negeli v Nemčiji, Louis Georges Gouy v Franciji, trije belgijski duhovniki. - Jezuiti Carbonelli, Delso in Tirion ter drugi. Med temi znanstveniki je bil pozneje slavni angleški fizik in kemik William Ramsay. Postopoma je postalo jasno, da na najmanjša zrnca snovi z vseh strani udarjajo še manjši delci, ki jih skozi mikroskop ne vidimo več – tako kot valovi, ki zibljejo oddaljeno barko, niso vidni z obale, medtem ko se premikanje barke ne vidi več. same so precej jasno vidne. Kot so zapisali v enem od člankov leta 1877, »...zakon velikih števil ne reducira več učinka trkov na povprečni enotni tlak; njihova rezultanta ne bo več enaka nič, ampak bo nenehno spreminjala svojo smer in velikost.”
Kakovostno je bila slika precej verjetna in celo vizualna. Majhna vejica ali žuželka, ki jo številne mravlje potiskajo (ali vlečejo) v različne smeri, bi se morala premikati približno enako. Ti manjši delci so bili pravzaprav v besednjaku znanstvenikov, vendar jih nihče ni nikoli videl. Imenovali so jih molekule; V prevodu iz latinščine ta beseda pomeni "majhna masa". Presenetljivo je, da je natanko to razlago podobnega pojava dal rimski filozof Tit Lukrecij Kar (okoli 99–55 pr. n. št.) v svoji slavni pesmi O naravi stvari. V njem najmanjše delce, očem nevidne, imenuje »prvotni principi« stvari.
Načela stvari se najprej premikajo sama,
Sledijo jim telesa iz njihove najmanjše kombinacije,
Po moči tako rekoč blizu primarnim načelom,
Skriti pred njimi, deležni šokov, si začnejo prizadevati,
Sami, da se premaknejo, nato pa spodbujajo večja telesa.
Torej, začenši od začetka, gibanje malo po malo
Dotakne se naših občutkov in postane tudi vidno
Za nas in v drobcih prahu, ki se premikajo v sončni svetlobi,
Čeprav so tresljaji, iz katerih nastane, neopazni ...
Kasneje se je izkazalo, da se je Lukrecij motil: Brownovega gibanja je nemogoče opazovati s prostim očesom in prašni delci v sončnem žarku, ki je prodrl v temno sobo, "plešejo" zaradi vrtinčnih gibanj zraka. Toda navzven imata oba pojava nekaj podobnosti. In šele v 19. stoletju. Mnogim znanstvenikom je postalo očitno, da gibanje Brownovih delcev povzročajo naključni udarci molekul medija. Gibajoče se molekule trčijo ob delce prahu in druge trdne delce, ki so v vodi. Višja kot je temperatura, hitrejše je gibanje. Če je drobec prahu velik, ima na primer velikost 0,1 mm (premer je milijonkrat večji od premera molekule vode), potem so številni hkratni udarci nanj z vseh strani medsebojno uravnoteženi in praktično ni "Občutite" jih - približno enako kot kos lesa velikosti krožnika ne bo "občutil" napora številnih mravelj, ki ga bodo vlekle ali potiskale v različne smeri. Če je prašni delec relativno majhen, se bo pod vplivom udarcev okoliških molekul premaknil v eno ali drugo smer.
Brownovi delci imajo velikost reda 0,1–1 μm, tj. od tisočinke do desettisočinke milimetra, zato je Brown lahko razločil njihovo gibanje, saj je gledal drobna citoplazemska zrnca in ne sam cvetni prah (o čemer se pogosto zmotno piše). Težava je v prevelikih celicah cvetnega prahu. Tako je pri cvetnem prahu travniških trav, ki ga prenaša veter in povzroča alergijske bolezni pri ljudeh (seneni nahod), velikost celic običajno v območju 20 - 50 mikronov, tj. so preveliki za opazovanje Brownovega gibanja. Pomembno je tudi omeniti, da se posamezna gibanja Brownovega delca pojavljajo zelo pogosto in na zelo kratkih razdaljah, tako da jih ni mogoče videti, pod mikroskopom pa so vidna gibanja, ki so se zgodila v določenem časovnem obdobju.
Zdi se, da je že samo dejstvo obstoja Brownovega gibanja nedvoumno dokazovalo molekularno strukturo snovi, a že na začetku 20. st. Bili so znanstveniki, vključno s fiziki in kemiki, ki niso verjeli v obstoj molekul. Atomsko-molekularna teorija se je le počasi in s težavo uveljavljala. Tako je vodilni francoski organski kemik Marcelin Berthelot (1827–1907) zapisal: »Pojem molekule je z vidika našega znanja negotov, medtem ko je drug pojem - atom - povsem hipotetičen.« Slavni francoski kemik A. Saint-Clair Deville (1818–1881) je spregovoril še jasneje: »Ne sprejemam Avogadrovega zakona, niti atoma, niti molekule, ker nočem verjeti v tisto, česar ne morem niti videti niti opazovati. ” In nemški fizikalni kemik Wilhelm Ostwald (1853–1932), Nobelov nagrajenec, eden od utemeljiteljev fizikalne kemije, že v začetku 20. stoletja. odločno zanikal obstoj atomov. Uspelo mu je napisati kemijski učbenik v treh zvezkih, v katerem beseda "atom" sploh ni omenjena. Ostwald je 19. aprila 1904 z velikim poročilom na Kraljevi ustanovi pred člani Angleškega kemijskega društva poskušal dokazati, da atomi ne obstajajo in da je »to, čemur pravimo materija, le skupek energij, zbranih skupaj v danem mesto.”
Toda tudi tisti fiziki, ki so sprejeli molekularno teorijo, niso mogli verjeti, da je bila veljavnost atomsko-molekularne teorije dokazana na tako preprost način, zato so bili za razlago pojava predstavljeni različni alternativni razlogi. In to je povsem v duhu znanosti: dokler vzrok nekega pojava ni nedvoumno ugotovljen, je mogoče (in celo potrebno) postavljati različne hipoteze, ki jih je treba po možnosti preizkusiti eksperimentalno ali teoretično. Tako je leta 1905 v Enciklopedičnem slovarju Brockhaus in Efron izšel kratek članek profesorja fizike iz Sankt Peterburga N.A. Gezehusa, učitelja slavnega akademika A.F. Ioffeja. Gesehus je zapisal, da po mnenju nekaterih znanstvenikov Brownovo gibanje povzročajo »svetlobni ali toplotni žarki, ki prehajajo skozi tekočino«, in se skrči na »preproste tokove znotraj tekočine, ki nimajo nobene zveze z gibanjem molekul« in ti tokovi lahko povzroči "izhlapevanje, difuzija in drugi razlogi." Navsezadnje je bilo že znano, da zelo podobno gibanje prašnih delcev v zraku povzročajo ravno vrtinčni tokovi. Toda razlago, ki jo je dal Gesehus, bi zlahka eksperimentalno ovrgli: če skozi močan mikroskop pogledate dva Brownova delca, ki se nahajata zelo blizu drug drugega, se bo izkazalo, da sta njuna gibanja popolnoma neodvisna. Če bi ta gibanja povzročili kakršni koli tokovi v tekočini, bi se takšni sosednji delci gibali usklajeno.
Teorija Brownovega gibanja.
V začetku 20. stol. večina znanstvenikov je razumela molekularno naravo Brownovega gibanja. Toda vse razlage so ostale zgolj kvalitativne; nobena kvantitativna teorija ni zdržala eksperimentalnega testiranja. Poleg tega so bili sami eksperimentalni rezultati nejasni: fantastičen spektakel neprekinjenih drvečih delcev je hipnotiziral eksperimentatorje in niso natančno vedeli, katere značilnosti pojava je treba izmeriti.
Kljub navidezni popolni neurejenosti je bilo še vedno mogoče opisati naključna gibanja Brownovih delcev z matematičnim odnosom. Prvič je strogo razlago Brownovega gibanja leta 1904 podal poljski fizik Marian Smoluchowski (1872–1917), ki je v tistih letih delal na univerzi v Lvivu. Istočasno je teorijo tega pojava razvil Albert Einstein (1879–1955), takrat malo znani strokovnjak 2. razreda na patentnem uradu švicarskega mesta Bern. Njegov članek, objavljen maja 1905 v nemški reviji Annalen der Physik, je bil naslovljen O gibanju delcev, suspendiranih v tekočini v mirovanju, zahteva molekularno kinetična teorija toplote. S tem imenom je želel Einstein pokazati, da molekularno kinetična teorija zgradbe snovi nujno implicira obstoj naključnega gibanja najmanjših trdnih delcev v tekočinah.
Nenavadno je, da Einstein na samem začetku tega članka piše, da je seznanjen s samim pojavom, čeprav površno: »Možno je, da so obravnavana gibanja identična s tako imenovanim Brownovim molekularnim gibanjem, vendar razpoložljivi podatki so zame v zvezi s slednjimi tako netočni, da si nisem mogel oblikovati dokončnega mnenja.« In desetletja kasneje, že v poznem življenju, je Einstein v svojih spominih zapisal nekaj drugega – da Brownovega gibanja sploh ni vedel in ga je pravzaprav »ponovno odkril« zgolj teoretično: »Ne vedoč, da so opazovanja »Brownovega gibanja« že dolgo znano, odkril sem, da atomska teorija vodi v obstoj opazljivega gibanja mikroskopskih suspendiranih delcev.« Kakor koli že, Einsteinov teoretični članek se je končal z neposrednim pozivom eksperimentatorjem, naj eksperimentalno preizkusijo njegove zaključke: »Če bi lahko kateri koli raziskovalec kmalu odgovoril vprašanja, postavljena tukaj, vprašanja!" – s tako nenavadnim vzklikom konča svoj članek.
Odgovor na Einsteinov strasten poziv ni čakal dolgo.
Po teoriji Smoluchowski-Einstein je povprečna vrednost kvadrata premika Brownovega delca ( s 2) za čas t neposredno sorazmeren s temperaturo T in obratno sorazmerna z viskoznostjo tekočine h, velikostjo delcev r in Avogadrova konstanta
n A: s 2 = 2RTt/6ph rN A,
Kje R– plinska konstanta. Torej, če se v 1 minuti delec s premerom 1 μm premakne za 10 μm, se v 9 minutah premakne za 10 = 30 μm, v 25 minutah - za 10 = 50 μm itd. Pod podobnimi pogoji se bo delec s premerom 0,25 μm v enakih časovnih obdobjih (1, 9 in 25 min) premaknil za 20, 60 oziroma 100 μm, saj je = 2. Pomembno je, da zgornja formula vključuje Avogadrovo konstanto, ki je torej , lahko določimo s kvantitativnimi meritvami gibanja Brownovega delca, ki jih je opravil francoski fizik Jean Baptiste Perrin (1870–1942).
Leta 1908 je Perrin začel s kvantitativnimi opazovanji gibanja Brownovih delcev pod mikroskopom. Uporabil je ultramikroskop, izumljen leta 1902, ki je omogočal zaznavanje najmanjših delcev tako, da je nanje razpršil svetlobo iz močnega stranskega osvetljevalca. Perrin je iz gumija, zgoščenega soka nekaterih tropskih dreves (uporablja se tudi kot rumena akvarelna barva), pridobil drobne kroglice skoraj sferične oblike in približno enake velikosti. Te drobne kroglice so bile suspendirane v glicerolu, ki je vseboval 12 % vode; viskozna tekočina je preprečila pojav notranjih tokov v njej, ki bi zameglili sliko. Oborožen s štoparico, je Perrin zabeležil in nato skiciral (seveda v močno povečanem merilu) na list papirja z grafom položaj delcev v rednih intervalih, na primer vsake pol minute. S povezovanjem nastalih točk z ravnimi črtami je dobil zapletene trajektorije, nekatere izmed njih so prikazane na sliki (vzete so iz Perrinove knjige Atomi, objavljeno leta 1920 v Parizu). Tako kaotično, neurejeno gibanje delcev vodi do dejstva, da se premikajo v prostoru precej počasi: vsota segmentov je veliko večja od premika delca od prve točke do zadnje.

Zaporedni položaji vsakih 30 sekund treh Brownovih delcev - žvečilnih kroglic velikosti približno 1 mikrona. Ena celica ustreza razdalji 3 µm. Če bi Perrin lahko določil položaj Brownovih delcev ne po 30, temveč po 3 sekundah, bi se ravne črte med vsakimi sosednjimi točkami spremenile v enako zapleteno cik-cak zlomljeno črto, le v manjšem merilu.
S pomočjo teoretične formule in svojih rezultatov je Perrin dobil vrednost za Avogadrovo število, ki je bila za tisti čas precej natančna: 6,8 . 10 23 . Perrin je uporabil tudi mikroskop za preučevanje navpične porazdelitve Brownovih delcev ( cm. AVOGADROV ZAKON) in pokazal, da kljub delovanju gravitacije ostanejo viseče v raztopini. Perrin ima tudi druga pomembna dela. Leta 1895 je dokazal, da so katodni žarki negativni električni naboji (elektroni), leta 1901 pa je prvi predlagal planetarni model atoma. Leta 1926 je prejel Nobelovo nagrado za fiziko.
Rezultati, ki jih je dobil Perrin, so potrdili Einsteinove teoretične zaključke. To je naredilo močan vtis. Kot je mnogo let kasneje zapisal ameriški fizik A. Pais, »nikoli ne nehate biti presenečeni nad tem rezultatom, pridobljenim na tako preprost način: dovolj je, da pripravite suspenzijo kroglic, katerih velikost je velika v primerjavi z velikostjo preprostih molekul, vzemite štoparico in mikroskop in lahko določite Avogadrovo konstanto!« Lahko bi bili tudi presenečeni: opisi novih poskusov Brownovega gibanja se občasno še vedno pojavljajo v znanstvenih revijah (Nature, Science, Journal of Chemical Education)! Po objavi Perrinovih rezultatov je Ostwald, nekdanji nasprotnik atomizma, priznal, da »sovpadanje Brownovega gibanja z zahtevami kinetične hipoteze ... zdaj daje najbolj previdnemu znanstveniku pravico, da govori o eksperimentalnem dokazu atomske teorije. snovi. Tako je bila atomska teorija povzdignjena v rang znanstvene, dobro utemeljene teorije.” Ponavlja ga francoski matematik in fizik Henri Poincaré: »Briljantna Perrinova določitev števila atomov je dopolnila zmagoslavje atomizma ... Atom kemikov je zdaj postal resničnost.«
Brownovo gibanje in difuzija.
Gibanje Brownovih delcev je po videzu zelo podobno gibanju posameznih molekul zaradi njihovega toplotnega gibanja. To gibanje imenujemo difuzija. Še pred delom Smoluchowskega in Einsteina so bili ugotovljeni zakoni gibanja molekul v najpreprostejšem primeru plinastega stanja snovi. Izkazalo se je, da se molekule v plinih premikajo zelo hitro – s hitrostjo naboja, ne morejo pa leteti daleč, saj zelo pogosto trčijo z drugimi molekulami. Na primer, molekule kisika in dušika v zraku, ki se gibljejo s povprečno hitrostjo približno 500 m/s, vsako sekundo doživijo več kot milijardo trkov. Zato bi bila pot molekule, če bi ji bilo mogoče slediti, kompleksna lomljena črta. Brownovi delci prav tako opisujejo podobno trajektorijo, če je njihov položaj zabeležen v določenih časovnih intervalih. Tako difuzija kot Brownovo gibanje sta posledica kaotičnega toplotnega gibanja molekul in ju zato opisujejo podobni matematični odnosi. Razlika je v tem, da se molekule v plinih gibljejo premočrtno, dokler ne trčijo z drugimi molekulami, nato pa spremenijo smer. Brownov delec, za razliko od molekule, ne izvaja nobenih "prostih letov", ampak doživlja zelo pogoste majhne in neenakomerne "trepetaje", zaradi katerih se kaotično premika v eno ali drugo smer. Izračuni so pokazali, da se pri delcu velikosti 0,1 µm en premik zgodi v treh milijardah sekunde na razdalji le 0,5 nm (1 nm = 0,001 µm). Kot je primerno rekel neki avtor, to spominja na premikanje prazne pločevinke piva na trgu, kjer se je zbrala množica ljudi.
Difuzijo je veliko lažje opazovati kot Brownovo gibanje, saj ne potrebuje mikroskopa: gibanja ne opazujemo posameznih delcev, temveč njihovih ogromnih mas, zagotoviti morate le, da difuzije ne prekriva konvekcija – mešanje snovi kot posledica vrtinčnih tokov (takšne tokove zlahka opazimo, če v kozarec vroče vode kanemo kapljico obarvane raztopine, na primer črnila).
Difuzijo je priročno opazovati v gostih gelih. Takšen gel lahko pripravimo na primer v kozarcu za penicilin, tako da v njem pripravimo 4–5 % raztopino želatine. Želatina mora najprej nekaj ur nabrekniti, nato pa jo ob mešanju povsem raztopimo tako, da kozarec spustimo v vrelo vodo. Po ohlajanju dobimo netekoč gel v obliki prozorne, rahlo motne mase. Če z ostro pinceto v sredino te mase previdno vstavite kristalček kalijevega permanganata (»kalijev permanganat«), bo kristal ostal viseti na mestu, kjer je ostal, saj gel preprečuje, da bi padel. V nekaj minutah bo okoli kristala začela rasti vijolična kroglica, ki bo sčasoma postajala vse večja in večja, dokler stene kozarca ne popačijo njene oblike. Enak rezultat lahko dosežemo s kristalom bakrovega sulfata, le v tem primeru krogla ne bo vijolična, ampak modra.
Jasno je, zakaj je krogla nastala: MnO 4 – ioni, ki nastanejo ob raztapljanju kristala, preidejo v raztopino (gel je v glavnem voda) in se zaradi difuzije enakomerno gibljejo v vse smeri, medtem ko gravitacija praktično ne vpliva na hitrost difuzije. Difuzija v tekočini je zelo počasna: trajalo bo več ur, da kroglica zraste nekaj centimetrov. Pri plinih je difuzija veliko hitrejša, a vseeno, če zrak ne bi bil mešan, bi se vonj po parfumu ali amoniaku širil po prostoru ure in ure.
Brownova teorija gibanja: naključni sprehodi.
Smoluchowski-Einsteinova teorija pojasnjuje zakone tako difuzije kot Brownovega gibanja. Te vzorce lahko obravnavamo na primeru difuzije. Če je hitrost molekule u, nato pa se gibljejo v ravni črti, v času t bo šel na daljavo L = ut, vendar se zaradi trkov z drugimi molekulami ta molekula ne giblje premočrtno, temveč sproti spreminja smer svojega gibanja. Če bi bilo mogoče skicirati pot molekule, se v osnovi ne bi razlikovala od risb, ki jih je dobil Perrin. Iz teh slik je razvidno, da se zaradi kaotičnega gibanja molekula premakne za razdaljo s, bistveno manj kot L. Te količine so povezane z razmerjem s= , kjer je l razdalja, ki jo molekula preleti od enega trka do drugega, povprečna prosta pot. Meritve so pokazale, da za molekule zraka pri normalnem atmosferskem tlaku l ~ 0,1 μm, kar pomeni, da bo pri hitrosti 500 m/s molekula dušika ali kisika preletela razdaljo v 10.000 sekundah (manj kot tri ure) L= 5000 km in se bo premaknil iz prvotnega položaja le za s= 0,7 m (70 cm), zato se snovi zaradi difuzije tudi v plinih gibljejo tako počasi.
Pot molekule kot posledica difuzije (ali pot Brownovega delca) imenujemo naključni sprehod. Duhoviti fiziki so ta izraz reinterpretirali kot pijanec hojo - "pot pijanca." Dejansko gibanje delca iz enega položaja v drugega (ali pot molekule, ki je podvržena številnim trkom) spominja na gibanje pijanega človeka. Še več, ta analogija omogoča tudi precej preprosto izpeljavo osnovne enačbe takega procesa, ki temelji na primeru enodimenzionalnega gibanja, ki ga je enostavno posplošiti na tridimenzionalno.
Recimo, da je pijani mornar pozno zvečer prišel iz gostilne in se napotil po ulici. Ko je prehodil pot l do najbližje svetilke, si je odpočil in šel ... ali naprej, do naslednje svetilke, ali nazaj, v gostilno - navsezadnje se ne spomni, od kod je prišel. Vprašanje pa je, ali bo kdaj zapustil bučko, ali bo le taval okoli nje, se ji zdaj odmikal, zdaj približeval? (Druga različica problema navaja, da so na obeh koncih ulice umazani jarki, kjer se končajo ulične luči, in sprašuje, ali se bo mornar lahko izognil padcu v enega od njih.) Intuitivno se zdi, da je drugi odgovor pravilen. Vendar je napačno: izkaže se, da se bo mornar postopoma vedno bolj oddaljeval od ničelne točke, čeprav veliko počasneje, kot če bi hodil samo v eno smer. Evo, kako to dokazati.
Ko bo mornar prvič šel do najbližje svetilke (desno ali levo), bo na razdalji s 1 = ± l od začetne točke. Ker nas zanima le njegova oddaljenost od te točke, ne pa tudi smer, se bomo znakov znebili s kvadriranjem tega izraza: s 1 2 = l 2. Čez nekaj časa je mornar, ko je že končal n»potepanja«, bo na daljavo
s N= od začetka. In ko sem spet hodil (v eno smer) do najbližje svetilke, na daljavo s N+1 = s N± l ali, z uporabo kvadrata premika, s 2 n+1 = s 2 n± 2 s N l + l 2. Če jadralec ta gib večkrat ponovi (od n prej n+ 1), nato kot rezultat povprečenja (prehaja z enako verjetnostjo n korak v desno ali levo), člen ± 2 s N Preklical bom, torej s 2 n+1 = s2 n+ l 2> (oklepaji označujejo povprečno vrednost) L = 3600 m = 3,6 km, medtem ko bo premik od ničelne točke za isti čas enak le s= = 190 m V treh urah bo minilo L= 10,8 km in se bo premaknil za s= 330 m itd.
delo u l v dobljeni formuli lahko primerjamo z difuzijskim koeficientom, ki je, kot je pokazal irski fizik in matematik George Gabriel Stokes (1819–1903), odvisen od velikosti delcev in viskoznosti medija. Na podlagi podobnih razmišljanj je Einstein izpeljal svojo enačbo.
Teorija Brownovega gibanja v resničnem življenju.
Teorija naključnih sprehodov ima pomembno praktično uporabo. Pravijo, da človek v odsotnosti orientacijskih točk (sonca, zvezd, hrupa avtoceste ali železnice itd.) tava v gozdu, po polju v snežnem metežu ali v gosti megli v krogih in se vedno vrača k svojemu izvirno mesto. Pravzaprav ne hodi v krogu, ampak približno tako, kot se gibljejo molekule oziroma Brownovi delci. Lahko se vrne na prvotno mesto, vendar le po naključju. A velikokrat mu prekriža pot. Pravijo tudi, da so ljudi, zmrznjene v snežnem metežu, našli "nekaj kilometra" od najbližjega stanovanja ali ceste, v resnici pa oseba ni imela možnosti, da bi ta kilometer prehodila, in tukaj je razlog.
Če želite izračunati, koliko se bo oseba premaknila zaradi naključnih sprehodov, morate poznati vrednost l, tj. razdalja, ki jo človek lahko prehodi v ravni črti brez orientacijskih točk. To vrednost je izmeril doktor geoloških in mineraloških znanosti B. S. Gorobets s pomočjo študentov prostovoljcev. Seveda jih ni pustil v gostem gozdu ali na zasneženem igrišču, vse je bilo bolj preprosto - študenta so postavili na sredino praznega stadiona, mu zavezali oči in ga prosili, naj hodi do konca nogometnega igrišča v popolna tišina (za izključitev orientacije po zvokih). Izkazalo se je, da je učenec v povprečju hodil po ravni črti le približno 20 metrov (odstopanje od idealne ravnine ni presegalo 5°), nato pa je začel vse bolj odstopati od prvotne smeri. Na koncu se je ustavil, daleč od tega, da bi dosegel rob.
Naj zdaj človek hodi (oziroma tava) po gozdu s hitrostjo 2 kilometra na uro (za cesto je to zelo počasi, za gost gozd pa zelo hitro), potem če je vrednost l 20 metrov, potem bo v eni uri pretekel 2 km, vendar se bo premaknil le 200 m, v dveh urah - približno 280 m, v treh urah - 350 m, v 4 urah - 400 m itd. In premikanje v ravni črti na s takšno hitrostjo bi človek prehodil 8 kilometrov v 4 urah, zato je v varnostnih navodilih za terensko delo naslednje pravilo: če se mejniki izgubijo, morate ostati na mestu, postaviti zavetje in počakati na konec slabega vremena (lahko posije sonce) ali po pomoč. V gozdu vam bodo mejniki - drevesa ali grmičevje - pomagali premikati v ravni črti in vsakič se morate držati dveh takih mejnikov - enega spredaj, drugega zadaj. Seveda pa je najbolje vzeti s seboj kompas ...
Ilya Leenson
Literatura:
Mario Liozzi. Zgodovina fizike. M., Mir, 1970
Kerker M. Brownovska gibanja in molekularna realnost pred letom 1900. Journal of Chemical Education, 1974, letn. 51, št. 12
Leenson I.A. Kemijske reakcije. M., Astrel, 2002
Eden od posrednih dokazov, da so vse snovi sestavljene iz naključno gibajočih se atomov in molekul je Brownovo gibanje.
To je neprekinjeno kaotično gibanje delcev, suspendiranih v tekočini ali plinu.
Razlog za to gibanje je trk molekul z delcem, ki se med seboj ne kompenzirata.
Če pogledate skozi steklo steklenice v svetlobo, lahko vidite, kako se prašni delci kaotično gibljejo v zraku.
Opažanja Roberta Browna
Leta 1827 je škotski botanik Robert Brown poročal o svojih opažanjih znanstveni skupnosti. Vodi je dodal drobna zrnca cvetnega prahu, jih osvetlil z intenzivno svetlobo in opazoval pod mikroskopom.
Brown je odkril močno, neprekinjeno in cikcakasto gibanje teh delcev v vodi, čeprav je bila površina tekočine popolnoma nepremična.
Takrat ni mogel pojasniti, kaj je postalo vir tega gibanja. Vzrok za pojav naj bi bila temperaturna razlika v notranjosti vode in tresenje mize, na kateri so izvajali poskus.
Do konca stoletja so bili znanstveniki skeptični glede Brownovega gibanja. Le redki so ga imeli za potrditev molekularno kinetične teorije zgradbe snovi.
Drugi fiziki so vztrajali, da atomi in molekule dejansko ne obstajajo kot resnični predmeti, ampak so matematični koncepti, uporabni za izračun rezultatov kemičnih reakcij.
Einsteinova teorija in Perrinov eksperiment
Leta 1905 je Albert Einstein, ne da bi vedel za Brownova opažanja, objavil članek, v katerem je z matematičnimi izračuni sklepal, da če majhen delec snovi postavimo v vodo, se bo ta začel premikati v različnih smereh. Gibanje delca bo posledica bombardiranja z vseh strani z vodnimi molekulami. V določenem trenutku molekule vode zadenejo delec bolj na eni strani kot na drugi, kar povzroči na videz naključen vzorec gibanja. Einsteinovo delo je postalo prvi teoretični argument za obstoj molekul in atomov.
Leta 1909 je poskus francoskega znanstvenika Jeana Baptista Perrina potrdil Einsteinovo formulo, objavljeno leta 1905, in pomagal dokazati obstoj atomov in molekul. Ta dokaz mu je leta 1926 prinesel Nobelovo nagrado za fiziko.
 Po Einsteinovih enačbah, ki statistično opisujejo Brownovo gibanje, bi se morali nekateri delci, suspendirani v vodi, gibati v nasprotni smeri od delujoče sile gravitacije. Ker jim molekule vode dajejo zagon in spreminjajo smer njihovega gibanja.
Po Einsteinovih enačbah, ki statistično opisujejo Brownovo gibanje, bi se morali nekateri delci, suspendirani v vodi, gibati v nasprotni smeri od delujoče sile gravitacije. Ker jim molekule vode dajejo zagon in spreminjajo smer njihovega gibanja.
Perrin je leta 1908 začel skrbno opazovati obnašanje delcev ekstrakta dlesni, da bi določil približno velikost vodnih molekul.
Večmesečno izolacijo je preživel ob opazovanju kosov gumiguta, težkih 0,1 grama. Po Einsteinovi molekularni teoriji vsi delci ne bodo potonili na dno suspenzije. Jean Perrin je preštel število delcev na različnih globinah v eni kapljici tekočine, globoke 0,12 mm. Koncentracija delcev je eksponentno padala z višino, v skladu z matematičnimi napovedmi Einsteinove teorije.

Einstein je koncept Avogadrovega števila (6,023 * 10 23) povezal z Brownovim gibanjem. Perrin je to vrednost dobil z izračuni na podlagi podatkov, pridobljenih v laboratoriju.
Med Nobelovim govorom je dejal: »Če molekule in atomi res obstajajo, so nam njihove relativne teže znane. Ko poznamo Avogadrovo število, lahko poznamo njihovo absolutno težo."
Danes si bomo podrobneje ogledali pomembno temo - definirali bomo Brownovo gibanje majhnih koščkov snovi v tekočini ali plinu.
Zemljevid in koordinate
Nekateri šolarji, ki jih mučijo dolgočasne lekcije, ne razumejo, zakaj študirati fiziko. Medtem pa je prav ta znanost nekoč omogočila odkritje Amerike!
Začnimo od daleč. Starodavne civilizacije v Sredozemlju so imele v nekem smislu srečo: razvile so se na obalah zaprtega celinskega vodnega telesa. Sredozemsko morje se imenuje tako, ker je z vseh strani obdano s kopnim. In starodavni popotniki so lahko s svojo ekspedicijo pripotovali precej daleč, ne da bi izgubili obale izpred oči. Obrisi zemlje so pomagali pri navigaciji. In prvi zemljevidi so bili sestavljeni bolj opisno kot geografsko. Zahvaljujoč tem razmeroma kratkim potovanjem so Grki, Feničani in Egipčani postali zelo dobri v gradnji ladij. In kjer je najboljša oprema, je želja po premikanju meja svojega sveta.
Zato so se evropske sile nekega lepega dne odločile za vstop v ocean. Med plovbo po neskončnih prostranstvih med celinami so mornarji dolge mesece videli samo vodo in morali so se nekako znajti. Izum natančnih ur in visokokakovostnega kompasa je pomagal določiti svoje koordinate.
Ura in kompas

Iznajdba majhnih ročnih kronometrov je zelo pomagala jadralcem. Da bi natančno ugotovili, kje so, so potrebovali preprost instrument, ki je meril višino sonca nad obzorjem in vedel, kdaj je točno poldne. In zahvaljujoč kompasu so kapitani ladij vedeli, kam gredo. Tako uro kot lastnosti magnetne igle so preučevali in ustvarili fiziki. Zahvaljujoč temu se je Evropejcem odprl ves svet.
Nove celine so bile terra incognita, neraziskane dežele. Na njih so rasle čudne rastline in našli so se čudne živali.
Rastline in fizika

Vsi naravoslovci civiliziranega sveta so hiteli preučevati te nove čudne ekološke sisteme. In seveda so skušali imeti od njih korist.
Robert Brown je bil angleški botanik. Potoval je v Avstralijo in Tasmanijo ter tam zbiral zbirke rastlin. Že doma v Angliji se je trudil z opisom in klasifikacijo prinesenega gradiva. In ta znanstvenik je bil zelo natančen. Nekega dne, ko je opazoval gibanje cvetnega prahu v rastlinskem soku, je opazil: majhni delci se nenehno kaotično gibljejo v cik-caku. To je definicija Brownovega gibanja majhnih elementov v plinih in tekočinah. Zahvaljujoč odkritju se je neverjetni botanik zapisal v zgodovino fizike!
Rjava in Gnjecava
V evropski znanosti je običajno, da učinek ali pojav poimenujemo po osebi, ki ga je odkrila. Toda pogosto se to zgodi po naključju. Kdor pa opiše, odkrije pomembnost ali podrobneje razišče fizikalni zakon, se znajde v senci. To se je zgodilo s Francozom Louisom Georgesom Gouyjem. Prav on je dal definicijo Brownovega gibanja (7. razred zagotovo ne sliši o tem, ko preučuje to temo v fiziki).
Gouyeve raziskave in lastnosti Brownovega gibanja

Francoski eksperimentator Louis Georges Gouy je opazoval gibanje različnih vrst delcev v več tekočinah, vključno z raztopinami. Takratna znanost je že znala natančno določiti velikost kosov snovi do desetink mikrometra. Med raziskovanjem, kaj je Brownovo gibanje (gouy je dal definicijo tega pojava v fiziki), je znanstvenik spoznal: intenzivnost gibanja delcev se poveča, če so postavljeni v manj viskozen medij. Ker je bil eksperimentator širokega spektra, je vzmetenje izpostavil svetlobi in elektromagnetnim poljem različnih jakosti. Znanstvenik je ugotovil, da ti dejavniki nikakor ne vplivajo na kaotične cikcakaste skoke delcev. Gouy je nedvoumno pokazal, kaj dokazuje Brownovo gibanje: toplotno gibanje molekul tekočine ali plina.
Ekipa in masa
Zdaj pa podrobneje opišemo mehanizem cik-cak skokov majhnih koščkov snovi v tekočini.
Vsaka snov je sestavljena iz atomov ali molekul. Ti elementi sveta so zelo majhni, noben optični mikroskop jih ne vidi. V tekočini ves čas nihajo in se premikajo. Ko katerikoli vidni delec vstopi v raztopino, je njegova masa tisočkrat večja od mase enega atoma. Brownovo gibanje molekul tekočine poteka kaotično. A kljub temu so vsi atomi oziroma molekule kolektiv, povezani so med seboj, kot ljudje, ki si podajo roke. Zato se včasih zgodi, da se atomi tekočine na eni strani delca premaknejo tako, da »pritisnejo« nanj, medtem ko se na drugi strani delca ustvari manj gosto okolje. Zato se prašni delci premikajo v prostoru raztopine. Drugje kolektivno gibanje molekul tekočine naključno vpliva na drugo stran masivnejše komponente. Natančno tako pride do Brownovega gibanja delcev.
Čas in Einstein

Če ima snov temperaturo, ki ni enaka nič, so njeni atomi izpostavljeni toplotnim vibracijam. Zato tudi v zelo hladni ali preohlajeni tekočini obstaja Brownovo gibanje. Ti kaotični skoki majhnih suspendiranih delcev se nikoli ne ustavijo.
Albert Einstein je morda najbolj znan znanstvenik dvajsetega stoletja. Vsakdo, ki ga vsaj malo zanima fizika, pozna formulo E = mc 2. Mnogi se morda spomnijo tudi fotoelektričnega učinka, za katerega je prejel Nobelovo nagrado, in posebne teorije relativnosti. Toda malo ljudi ve, da je Einstein razvil formulo za Brownovo gibanje.
Na podlagi molekularne kinetične teorije je znanstvenik izpeljal difuzijski koeficient suspendiranih delcev v tekočini. In to se je zgodilo leta 1905. Formula izgleda takole:
D = (R * T) / (6 * N A * a * π * ξ),
kjer je D želeni koeficient, R je univerzalna plinska konstanta, T je absolutna temperatura (izražena v Kelvinih), N A je Avogadrova konstanta (ustreza enemu molu snovi ali približno 10 23 molekul), a je približno povprečje polmer delcev, ξ je dinamična viskoznost tekočine ali raztopine.
In že leta 1908 so francoski fizik Jean Perrin in njegovi učenci eksperimentalno dokazali pravilnost Einsteinovih izračunov.
En delec na bojnem polju
Zgoraj smo opisali skupni vpliv okolja na številne delce. Toda že en tuj element v tekočini lahko povzroči nekatere vzorce in odvisnosti. Na primer, če dlje časa opazujete Brownov delec, lahko posnamete vsa njegova gibanja. In iz tega kaosa bo nastal harmoničen sistem. Povprečno gibanje Brownovega delca v kateri koli smeri je sorazmerno s časom.
Pri poskusih na delcu v tekočini so bile izčiščene naslednje količine:
- Boltzmannova konstanta;
- Avogadrovo število.
Poleg linearnega gibanja je značilno tudi kaotično vrtenje. In povprečni kotni premik je tudi sorazmeren s časom opazovanja.
Velikosti in oblike

Po takem razmišljanju se lahko pojavi logično vprašanje: zakaj tega učinka ne opazimo pri velikih telesih? Kajti ko je obseg predmeta, potopljenega v tekočino, večji od določene vrednosti, potem se vsi ti naključni skupni "potiski" molekul spremenijo v stalen pritisk, saj se povprečijo. In splošni Arhimed že deluje na telo. Tako se velik kos železa potopi, kovinski prah pa lebdi v vodi.
Velikost delcev, kot primer je prikazano nihanje molekul tekočine, ne sme presegati 5 mikrometrov. Pri velikih predmetih ta učinek ne bo opazen.