Vserusko testno delo VPR - kemija 11. razred
Pojasnila za vzorec vseruskega testnega dela
Ko se seznanite z vzorčnim preizkusnim delom, ne pozabite, da naloge, vključene v vzorec, ne odražajo vseh spretnosti in vsebinskih vprašanj, ki bodo preizkušena v okviru vseruskega testnega dela. Popoln seznam vsebinskih elementov in veščin, ki jih je mogoče preizkusiti pri delu, je naveden v kodifikatorju vsebinskih elementov in zahtev za stopnjo usposobljenosti diplomantov za razvoj vseruskega testa iz kemije. Namen vzorčnega testnega dela je dati idejo o strukturi vseruskega testnega dela, številu in obliki nalog ter njihovi stopnji zahtevnosti.
Navodila za izvedbo dela
Test obsega 15 nalog. Za dokončanje kemijskega dela je na voljo 1 ura 30 minut (90 minut).
Svoje odgovore oblikujte v besedilu dela v skladu z navodili za naloge. Če zapišete napačen odgovor, ga prečrtajte in zraven napišite novega.
Pri opravljanju dela je dovoljeno uporabljati naslednje dodatne materiale:
– Periodni sistem kemijskih elementov D.I. Mendelejev;
– tabela topnosti soli, kislin in baz v vodi;
– elektrokemijske serije kovinskih napetosti;
– neprogramabilni kalkulator.
Pri izpolnjevanju nalog lahko uporabite osnutek. Vnosi v osnutku ne bodo pregledani ali ocenjeni.
Svetujemo vam, da naloge opravljate v vrstnem redu, kot so podane. Če želite prihraniti čas, preskočite nalogo, ki je ne morete dokončati takoj, in nadaljujte z naslednjo. Če vam po opravljenem delu ostane čas, se lahko vrnete k zamujenim opravilom.
Točke, ki jih prejmete za opravljene naloge, se seštejejo. Poskusite opraviti čim več nalog in doseči največ točk.
Želimo vam uspeh!
1. Iz vašega predmeta kemije poznate naslednje metode za ločevanje zmesi: usedanje, filtracija, destilacija (destilacija), magnetno delovanje, izhlapevanje, kristalizacija. Na slikah 1–3 so prikazani primeri uporabe nekaterih od naštetih metod.
Katero od naslednjih metod za ločevanje zmesi je mogoče uporabiti za čiščenje:
1) moka iz železnih opilkov, ki so prišli vanjo;
2) voda iz v njej raztopljenih anorganskih soli?
V tabelo zapiši številko slike in naziv ustreznega načina ločevanja zmesi.
železne opilke privlači magnet
Med destilacijo po kondenzaciji vodne pare v posodi ostanejo kristali soli
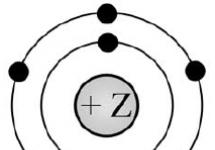
2. Slika prikazuje model elektronske strukture atoma neke kemikalijeelement.

Na podlagi analize predlaganega modela opravite naslednje naloge:
1) identificirati kemični element, katerega atom ima takšno elektronsko strukturo;
2) navedite številko obdobja in številko skupine v periodnem sistemu kemijskih elementov D.I. Mendelejev, v katerem se nahaja ta element;
3) ugotovite, ali je preprosta snov, ki tvori ta kemični element, kovina ali nekovina.
Odgovore zapiši v tabelo.
odgovor:
N; 2; 5 (ali V); nekovinsko
za določitev kemijskega elementa bi morali prešteti skupno število elektronov, ki jih vidimo na sliki (7)
če upoštevamo periodni sistem, zlahka določimo element (število najdenih elektronov je enako atomskemu številu elementa) (N-dušik)
po tem določimo številko skupine (navpični stolpec) (5) in naravo tega elementa (nekovinski)
3. Periodni sistem kemijskih elementov D.I. Mendelejev– bogato skladišče informacij o kemijskih elementih, njihovih lastnostih in lastnostih njihovih spojin, o vzorcih spreminjanja teh lastnosti, o načinih pridobivanja snovi, pa tudi o njihovi legi v naravi. Na primer, znano je, da se s povečanjem atomskega števila kemičnega elementa v obdobjih polmeri atomov zmanjšajo, v skupinah pa se povečajo.
Ob upoštevanju teh vzorcev razporedite naslednje elemente po naraščajočih atomskih polmerih: N, C, Al, Si. Zapišite oznake elementov v zahtevanem zaporedju.
Odgovor: __________________________
N → C → Si → Al
4. V spodnji tabeli so navedene značilne lastnosti snovi, ki imajo molekularno in ionsko zgradbo.
S pomočjo teh podatkov ugotovi, kakšno zgradbo imata snovi dušik N2 in kuhinjska sol NaCl. Odgovor zapiši v predviden prostor:
1) dušik N2 ________________________________________________________________
2) kuhinjska sol NaCl ____________________________________________________
dušik N2 – molekularna struktura;
kuhinjska sol NaCl – ionska struktura
5. Kompleksne anorganske snovi lahko pogojno razdelimo, torej razvrstimo v štiri skupine, kot prikazuje diagram. V ta diagram za vsako od štirih skupin vpišite manjkajoča imena skupin ali kemijske formule snovi (en primer formul), ki pripadajo tej skupini.

Zapišemo imena skupin: baze, soli;
zapisane so formule snovi ustreznih skupin
CaO, baze, HCl, soli
Preberite naslednje besedilo in dokončajte naloge 6–8.
Živilska industrija uporablja aditiv za živila E526, ki je kalcijev hidroksid Ca(OH)2. Uporablja se pri proizvodnji: sadnih sokov, otroške hrane, vloženih kumaric, kuhinjske soli, slaščic in slaščic.
Kalcijev hidroksid je mogoče proizvesti v industrijskem obsegu z mešanjem kalcijevega oksida z vodo, se ta proces imenuje kaljenje.
Kalcijev hidroksid se pogosto uporablja pri proizvodnji gradbenih materialov, kot so belilo, omet in mavčne malte. To je posledica njegove sposobnosti medsebojno delujejo z ogljikovim dioksidom CO2 vsebovan v zraku. Ista lastnost raztopine kalcijevega hidroksida se uporablja za merjenje količinske vsebnosti ogljikovega dioksida v zraku.
Uporabna lastnost kalcijevega hidroksida je njegova sposobnost, da deluje kot flokulant, ki čisti odpadno vodo iz suspendiranih in koloidnih delcev (vključno z železovimi solmi). Uporablja se tudi za zvišanje pH vode, saj naravna voda vsebuje snovi (npr. kisline), kar povzroča korozijo v vodovodnih ceveh.
1. Napišite molekularno enačbo za reakcijo, pri kateri nastane kalcijev hidroksid, ki
omenjeno v besedilu.
2. Pojasnite, zakaj se ta proces imenuje kaljenje.
Odgovor: ________________________________________________________________________________
________________________________________________________________________________
1) CaO + H 2 O = Ca(OH) 2
2) Ko kalcijev oksid medsebojno deluje z vodo, se sprosti velika količina
količino toplote, zato voda vre in sika, kot da bi zadela razgret premog, ko ogenj ugasnemo z vodo (oz. »ta proces imenujemo gašenje, ker pri tem nastane gašeno apno«)
1. Napišite molekularno enačbo reakcije med kalcijevim hidroksidom in ogljikovim dioksidom
plin, ki je bil omenjen v besedilu.
Odgovor: ________________________________________________________________________________
2. Pojasnite, katere značilnosti te reakcije omogočajo njeno uporabo za detekcijo
ogljikov dioksid v zraku.
Odgovor: ________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O
2) Kot rezultat te reakcije nastane netopna snov - kalcijev karbonat, opazimo motnost prvotne raztopine, kar nam omogoča presojo prisotnosti ogljikovega dioksida v zraku (kvalitativno
reakcija na CO 2)
1. Napišite skrajšano ionsko enačbo za v besedilu omenjeno reakcijo med
kalcijev hidroksid in klorovodikova kislina.
Odgovor: ________________________________________________________________________________
2. Pojasnite, zakaj se ta reakcija uporablja za povečanje pH vode.
Odgovor: ________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) OH – + H + = H 2 O (Ca(OH)2+ 2HCl = CaCl2 + 2H2O)
2) Prisotnost kisline v naravni vodi povzroča nizke vrednosti pH te vode. Kalcijev hidroksid nevtralizira kislino in pH vrednosti se zvišajo
Lestvica pH obstaja od 0-14. od 0-6 - kislo okolje, 7 - nevtralno okolje, 8-14 - alkalno okolje
9. Podan je diagram redoks reakcije.
H 2 S + Fe 2 O 3 → FeS + S + H 2 O
1. Naredite elektronsko tehtnico za to reakcijo.
Odgovor: ________________________________________________________________________________
2. Določite oksidant in reducent.
Odgovor: ________________________________________________________________________________
3. Razporedi koeficiente v enačbi reakcije.
Odgovor: ________________________________________________________________________________
1) Sestavljena je elektronska bilanca:
| 2Fe +3 + 2ē → 2Fe +2 | 2 | 1 | |
| 2 | |||
| S -2 – 2ē → S 0 | 2 | 1 |
2) Označeno je, da je žveplo v oksidacijskem stanju –2 (ali H 2 S) redukcijsko sredstvo, železo v oksidacijskem stanju +3 (ali Fe 2 O 3) pa je oksidacijsko sredstvo;
3) Reakcijska enačba je sestavljena:
3H 2 S + Fe 2 O 3 = 2FeS + S + 3H 2 O
10. Shema transformacije je podana:
Fe → FeCl 2 → Fe(NO 3) 2 → Fe(OH) 2
Napišite molekularne enačbe reakcij, ki jih je mogoče uporabiti za izvedbo
navedene transformacije.
1) _________________________________________________________________________
2) _________________________________________________________________________
3) _________________________________________________________________________
Reakcijske enačbe, ki ustrezajo transformacijski shemi, so zapisane:
1) Fe + 2HCl = FeCl 2 + H 2
2) FeCl 2 + 2AgNO 3 = Fe(NO 3) 2 + 2AgCl
3) Fe(NO 3) 2 + 2KOH = Fe(OH) 2 + 2KNO 3
(Dovoljene so druge enačbe, ki niso v nasprotju s pogoji za določanje enačb
reakcije.)
11. Vzpostavite ujemanje med formulo organske snovi in razredom/skupino, ki ji ta snov pripada: za vsako mesto, označeno s črko, izberite ustrezno mesto, označeno s številko.
Izbrane številke zapišite v tabelo pod pripadajoče črke.
odgovor:
| A | B | IN |
- C3H8 - CnH2n+2 - alkan
- C3H6 - CnH2n-alken
- C2H6O - CnH2n+2O- alkohol
12. V predlagane sheme kemijskih reakcij vstavi formule manjkajočih snovi in razporedi koeficiente.
1) C 2 H 6 + …………….. → C 2 H 5 Cl + HCl
2) C 3 H 6 + …………….. → CO 2 + H 2 O
1) C 2 H 6 + Cl 2 → C 2 H 5 Cl + HCl
2) 2C 3 H 6 + 9O 2 → 6CO 2 + 6H 2 O
(Možne so delne kvote.)
13. Propan gori z nizkimi stopnjami strupenih emisij v ozračje Zato se uporablja kot vir energije na številnih področjih, na primer v plinskih vžigalnikih in za ogrevanje podeželskih hiš.
Kakšna prostornina ogljikovega dioksida (CO) nastane, ko 4,4 g propana popolnoma zgori?
Zapišite podrobno rešitev problema.
Odgovor: ________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Enačba za reakcijo zgorevanja propana je bila sestavljena:
C 3 H 8 + 5 O 2 → 3 CO 2 + 4 H 2 O
2) n(C3H8) = 4,4/44 = 0,1 mol
n(CO 2) = 3n (C 3 H 8) = 0,3 mol
3) V(O 2) = 0,3 22,4 = 6,72 l
14. Izopropilni alkohol se uporablja kot univerzalno topilo: vključen je v gospodinjske kemikalije, parfume in kozmetiko ter tekočine za pranje vetrobranskega stekla za avtomobile. V skladu s spodnjim diagramom sestavite reakcijske enačbe za proizvodnjo tega alkohola. Pri pisanju reakcijskih enačb uporabljajte strukturne formule organskih snovi.

1) _______________________________________________________
2) _______________________________________________________
3) _______________________________________________________
Reakcijske enačbe, ki ustrezajo shemi, so zapisane:

(Dovoljene so druge reakcijske enačbe, ki niso v nasprotju s pogoji za določanje reakcijskih enačb.)
15. V medicini je fiziološka raztopina 0,9 % raztopina natrijevega klorida v vodi. Izračunajte maso natrijevega klorida in maso vode, potrebnih za pripravo 500 g fiziološke raztopine. Zapišite podrobno rešitev problema.
Odgovor: ________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) m(NaCl) = 4,5 g
2) m(voda) = 495,5 g
m(raztopina) = 500g m(sol) = x
x/500 * 100 %= 0,9 %
m(sol) = 500* (0,9/100)= 4,5 g
© 2017 Zvezna služba za nadzor v izobraževanju in znanosti Ruske federacije
Test št. 1 11. razred
Možnost 1.
Iz tečaja kemije veste naslednje:načine ločevanje zmesi:
.
načine.


Sl.1 Sl.2 Sl.3
1) moka iz železnih opilkov, ki so prišli vanjo;
2) voda iz v njej raztopljenih anorganskih soli?
mešanice. (
Moka in tisti, ki so ujeti vanjoželezni opilki
Voda z anorganskimi solmi, raztopljenimi v njej
element.

ta kemični element.
Odgovore zapiši v tabelo
Simbolkemična
element
Obdobje št.
Številka skupine
Kovina/nekovina
3. Periodni sistem kemijskih elementov D.I. Mendelejev - bogato skladišče
o njihovem pojavljanju v naravi. Na primer, znano je, da z naraščajočo serijsko št
kemijskega elementa se v obdobjih polmeri atomov zmanjšujejo, v skupinah pa povečujejo.
Upoštevajoč te vzorce, jih razporedi po naraščajočih atomskih radijih
naslednje elemente:C, Si, Al, N.
zaporedja.
4.
država;
vrenje in taljenje;
neprevodno;
krhek;
ognjevzdržni;
nehlapljivo;
elektrika
S pomočjo teh podatkov ugotovite, kakšno strukturo imajo snovi dušik N 2
in kuhinjska sol NaCl. (podajte podroben odgovor).
2
izdelkov in sladkarij.
avtor
CO2
ogljikov dioksid v zraku.
vsebuje snovi (npr.kisline
omenjeno v besedilu .
6.
.
9. Čeprav rastline in živali potrebujejo fosforjeve spojine kot element, ki je del vitalnih snovi, onesnaženje naravnih voda s fosfati izjemno negativno vpliva na stanje vodnih teles. Odvajanje fosfatov z odpadno vodo povzroči hiter razvoj modrozelenih alg, vitalna aktivnost vseh drugih organizmov pa je zavirana. Določite število kationov in anionov, ki nastanejo med disociacijo 25 molov natrijevega ortofosfata.
10. Podajte razlago:Včasih na podeželju ženske kombinirajo barvanje las s kano in umivanje v ruski kopeli. Zakaj barva postane bolj intenzivna?
11.
H 2 S + Fe 2 O 3 → FeS + S + H 2 O.
12. Propan gori z nizkimi stopnjami strupenih emisij v ozračje, zato se uporablja kot vir energije v številnih aplikacijah, kot je plin
Kakšna prostornina ogljikovega dioksida (CO) nastane pri popolnem zgorevanju 4,4 g propana?
13. V medicini je fiziološka raztopina 0,9% raztopina natrijevega klorida v vodi. Izračunajte maso natrijevega klorida in maso vode, potrebnih za pripravo 500 g fiziološke raztopine.
Zapišite podrobno rešitev problema .
Test št. 1 11. razred
Možnost 2.
1. Iz tečaja kemije veste naslednjenačine ločevanje zmesi:
sedimentacija, filtracija, destilacija (destilacija), magnetno delovanje, izparevanje, kristalizacija .
Slike 1–3 prikazujejo primere uporabe nekaterih od naštetih
načine.


Sl.1 Sl.2 Sl.3
Katero od naslednjih metod za ločevanje zmesi je mogoče uporabiti za čiščenje:
1) žveplo iz železovih opilkov, ki so prišli vanj;
2) voda iz delcev gline in peska?
V tabelo zapiši številko slike in ime pripadajočega načina deljenja
mešanice. (prepiši tabelo v svoj zvezek)
2. Slika prikazuje model elektronske strukture atoma neke kemikalije
element.

Na podlagi analize predlaganega modela opravite naslednje naloge:
1) identificirati kemični element, katerega atom ima takšno elektronsko strukturo;
2) navedite številko obdobja in številko skupine v periodnem sistemu kemikalij
elementi D.I. Mendelejev, v katerem se nahaja ta element;
3) ugotovi, ali je preprosta snov, ki nastane, kovina ali nekovina
ta kemični element.
Odgovore zapiši v tabelo(nariši tabelo v zvezek)
Simbolkemična
element
Obdobje št.
Številka skupine
Kovina/nekovina
3. Periodni sistem kemijskih elementov D.I. Mendelejev - bogato skladišče
informacije o kemičnih elementih, njihovih lastnostih in lastnostih njihovih spojin,
o vzorcih sprememb teh lastnosti, o metodah pridobivanja snovi, pa tudi
o njihovem pojavljanju v naravi. Na primer, znano je, da se elektronegativnost kemičnega elementa povečuje v obdobjih in zmanjšuje v skupinah.
Glede na te vzorce jih razporedite po naraščajoči elektronegativnosti
naslednje elemente:F, Na, N, Mg. V zahtevano zapiši oznake elementov
zaporedja.
4. V spodnji tabeli so navedene značilne lastnosti snovi, ki imajo molekularno in ionsko zgradbo.
v normalnih pogojih so tekoči,plinast in trden agregat
država;
imajo nizke temperature
vrenje in taljenje;
neprevodno;
imajo nizko toplotno prevodnost
trdna pod normalnimi pogoji;
krhek;
ognjevzdržni;
nehlapljivo;
izvajajo v talinah in raztopinah
elektrika
S pomočjo teh podatkov ugotovite, kakšno zgradbo imajo snovi kisik O 2
in soda Na 2 CO 3 . (podajte podroben odgovor).
Živilska industrija uporablja aditiv za živila E526, ki
je kalcijev hidroksid Ca(OH)2 . Najde uporabo v proizvodnji:
sadni sokovi, otroška hrana, vložene kumare, kuhinjska sol, slaščice
izdelkov in sladkarij.
Kalcijev hidroksid je mogoče proizvesti v industrijskem obseguavtor
mešanje kalcijevega oksida z vodo , se ta proces imenuje kaljenje.
Kalcijev hidroksid se pogosto uporablja pri proizvodnji takih gradbenih materialov.
materiali, kot so belilo, omet in mavčne malte. To je posledica njegove sposobnosti
interakcijo z ogljikovim dioksidom CO2 vsebovan v zraku. To je ista lastnina
za merjenje kvantitativne vsebnosti se uporablja raztopina kalcijevega hidroksida
ogljikov dioksid v zraku.
Uporabna lastnost kalcijevega hidroksida je njegova sposobnost, da deluje kot
flokulant, ki čisti odpadno vodo iz suspendiranih in koloidnih delcev (vključno z
železove soli). Uporablja se tudi za povečanje pH vode, saj naravna voda
vsebuje snovi (npr.kisline ), kar povzroča korozijo v vodovodnih ceveh.
5. Napišite molekularno enačbo za reakcijo, pri kateri nastane kalcijev hidroksid, ki
omenjeno v besedilu .
6. Pojasnite, zakaj se ta postopek imenuje kaljenje.
7. Napišite molekularno enačbo reakcije med kalcijevim hidroksidom in ogljikovim dioksidom
plin, ki je bil omenjen v besedilu. Pojasnite, katere značilnosti te reakcije omogočajo uporabo za zaznavanje ogljikovega dioksida v zraku.
8. Napiši skrajšano ionsko enačbo za reakcijo, omenjeno v besedilu med
kalcijev hidroksid in klorovodikova kislina .
9. Čeprav rastline in živali potrebujejo fosforjeve spojine kot element, ki je del vitalnih snovi, onesnaženje naravnih voda s fosfati izjemno negativno vpliva na stanje vodnih teles. Odvajanje fosfatov z odpadno vodo povzroči hiter razvoj modrozelenih alg, vitalna aktivnost vseh drugih organizmov pa je zavirana. Določite število kationov in anionov, ki nastanejo med disociacijo 15 molov kalijevega ortofosfata.
10. Podajte razlago:Zakaj se vse vrste oblikovanja las običajno izvajajo s toploto?
11. Podana je shema redoks reakcije
Uredite koeficiente. Zabeležite elektronsko bilanco.
Določite oksidant in reducent.
12. Propan gori z nizkimi stopnjami strupenih emisij v ozračje, zato se uporablja kot vir energije na številnih področjih, kot je plin
vžigalnike in pri ogrevanju podeželskih hiš.
Kakšna prostornina ogljikovega dioksida (CO) nastane pri popolnem zgorevanju 5 g propana?
Zapišite podrobno rešitev problema.
13. Farmacevt mora pripraviti 5% raztopino joda, ki se uporablja za zdravljenje ran.
Kolikšno količino raztopine lahko pripravi farmacevt iz 10 g kristalnega joda, če mora biti gostota raztopine 0,950 g/ml?
Test obsega 15 nalog. Za dokončanje kemijskega dela je na voljo 1 ura 30 minut (90 minut).
Iz predmeta kemije poznate naslednje metode ločevanja zmesi: usedanje, filtracija, destilacija (destilacija), magnetno delovanje, izhlapevanje, kristalizacija.
Slike 1-3 prikazujejo situacije, v katerih se uporabljajo te metode spoznavanja.



Katere od metod, prikazanih na slikah, NI MOGOČE uporabiti za ločevanje mešanice:
1) aceton in butanol-1;
2) glina in rečni pesek;
3) barijev sulfat in aceton?
Pokaži odgovor
Slika prikazuje model elektronske zgradbe atoma določenega kemičnega elementa.

Na podlagi analize predlaganega modela:
1) Določite kemijski element, katerega atom ima takšno elektronsko strukturo.
2) Navedite številko obdobja in številko skupine v periodnem sistemu kemijskih elementov D.I. Mendelejeva, v katerem se nahaja ta element.
3) Ugotovite, ali je preprosta snov, ki jo tvori ta kemični element, kovina ali nekovina.
Pokaži odgovor
Li; 2; 1 (ali jaz); kovina
Periodni sistem kemijskih elementov D.I. Mendelejev je bogato skladišče informacij o kemičnih elementih, njihovih lastnostih in lastnostih njihovih spojin, o vzorcih sprememb teh lastnosti, o načinih pridobivanja snovi, pa tudi o njihovi lokaciji v naravi. Na primer, znano je, da se s povečanjem atomskega števila kemičnega elementa v obdobjih elektronegativnost atomov poveča, v skupinah pa se zmanjša.
Ob upoštevanju teh vzorcev razporedite naslednje elemente po padajoči elektronegativnosti: B, C, N, Al. Zapišite oznake elementov v zahtevanem zaporedju.
Pokaži odgovor
N → C → B → Al
Spodaj so navedene značilne lastnosti snovi, ki imajo molekularno in atomsko zgradbo.
Značilne lastnosti snovi
molekularna struktura
krhek;
Ognjevarna;
Nehlapljivo;
Raztopine in taline prevajajo električni tok.
ionska struktura
Trden pri normalnih pogojih;
krhek;
Ognjevarna;
Nehlapljivo;
Netopen v vodi, ne prevaja električnega toka.
S pomočjo teh podatkov ugotovi, kakšno strukturo imata snovi: diamant C in kalijev hidroksid KOH. Odgovor zapiši v za to namenjen prostor.
1. Diamond S
2. Kalijev hidroksid KOH
Pokaži odgovor
Diamant C ima atomsko strukturo, kalijev hidroksid KOH ima ionsko strukturo
Okside običajno razdelimo v štiri skupine, kot je prikazano na diagramu. V ta diagram za vsako od štirih skupin vpišite manjkajoča imena skupin ali kemijske formule oksidov (en primer formul), ki pripadajo tej skupini.

Pokaži odgovor
Elementi odziva:
Imena skupin so zapisana: amfoterna, osnovna; Zapisane so formule snovi ustreznih skupin.
(Drugače besedilo odgovora je dovoljeno brez izkrivljanja njegovega pomena.)
Preberite naslednje besedilo in dokončajte naloge 6–8
Natrijev karbonat (natrijev karbonat, Na 2 CO 3) se uporablja v proizvodnji stekla, izdelavi mila in proizvodnji pralnih in čistilnih praškov, emajlov, za pridobivanje ultramarinskega barvila. Uporablja se tudi za mehčanje vode v parnih kotlih in na splošno za zmanjšanje trdote vode. V prehrambeni industriji so natrijevi karbonati registrirani kot aditiv za živila E500 - regulator kislosti, vzhajalno sredstvo in sredstvo proti strjevanju.
Natrijev karbonat lahko dobimo z reakcijo alkalij in ogljikovega dioksida. Leta 1861 je belgijski kemijski inženir Ernest Solvay patentiral metodo za proizvodnjo sode, ki se uporablja še danes. Ekvimolarne količine plinov amoniaka in ogljikovega dioksida se prenesejo v nasičeno raztopino natrijevega klorida. Oborjeni ostanek rahlo topnega natrijevega bikarbonata se filtrira in kalcinira (kalcinira) s segrevanjem na 140-160 ° C, pri čemer se spremeni v natrijev karbonat.
Rimski zdravnik Dioscorides Pedanius je pisal o sodi kot o snovi, ki sika s sproščanjem plina, ko je izpostavljena kislinam, ki so bile takrat znane - ocetni CH 3 COOH in žveplovi H 2 SO 4.
1) Zapišite molekularno enačbo, navedeno v besedilu, za reakcijo nastajanja natrijevega karbonata z interakcijo alkalije in ogljikovega dioksida.
2) Kaj je milo s kemičnega vidika?
Pokaži odgovor
1) 2NaOH + CO 2 = Na 2 CO 3 + H 2 O
2) Milo je s kemijskega vidika natrijeva ali kalijeva sol ene od višjih karboksilnih kislin (palmitinske, stearinske...)
1) V molekularni obliki zapišite v besedilu navedeno enačbo za razgradnjo natrijevega bikarbonata, pri kateri nastane natrijev karbonat.
2) Kaj je "trdota vode"?
Pokaži odgovor
1) Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O
2) Znak reakcije je nastanek bele oborine kalcijevega karbonata
1) V skrajšani ionski obliki zapišite enačbo interakcije sode z ocetno kislino, navedeno v besedilu.
2) Med katere elektrolite – močne ali šibke – spada natrijev karbonat?
Pokaži odgovor
1) Ca(OH) 2 + FeSO 4 = Fe(OH) 2 ↓ + CaSO 4 ↓
2) Kot rezultat reakcije se obori železov hidroksid in vsebnost železa v vodi se znatno zmanjša
Podana je shema redoks reakcije:
HIO 3 + H 2 O 2 → I 2 + O 2 + H 2 O
1) Ustvarite elektronsko tehtnico za to reakcijo.
2) Določite oksidant in reducent.
3) Razporedi koeficiente v enačbi reakcije.
Pokaži odgovor
1) Sestavljena je elektronska bilanca:
2) Označeno je, da je oksidant I +5 (ali jodna kislina), redukcijsko sredstvo O -1 (ali vodikov peroksid);
3) Reakcijska enačba je sestavljena:
2НIO 3 + 5Н 2 O 2 = I 2 + 5O 2 + 6Н 2 O
Shema transformacije je podana:
P → P 2 O 5 → Ca 3 (PO 4) 2 → Ca (H 2 PO 4) 2
Napišite enačbe molekularnih reakcij, ki jih je mogoče uporabiti za izvedbo teh transformacij.
Pokaži odgovor
1) 4P + 5O 2 = 2P 2 O 5
2) P 2 O 5 + ZCaO = Ca 3 (PO 4) 2
3) Ca 3 (PO 4) 2 + 4H 3 PO 4 = ZCa (H 2 PO 4) 2
Vzpostavite ujemanje med razredom organskih snovi in formulo njegovega predstavnika: za vsako mesto, označeno s črko, izberite ustrezno mesto, označeno s številko.
RAZRED SNOVI
A) 1,2-dimetil benzen
VPR. kemija. Šifra 11. razreda
RAZRED 11 Pojasnila za vzorec vseruskega testnega dela Ko se seznanite z vzorčnim testnim delom, ne pozabite, da naloge, vključene v vzorec, ne odražajo vseh spretnosti in vsebinskih vprašanj, ki bodo preizkušena kot del vse-rusko testno delo. Popoln seznam vsebinskih elementov in veščin, ki jih je mogoče preizkusiti pri delu, je naveden v kodifikatorju vsebinskih elementov in zahtev za stopnjo usposobljenosti diplomantov za razvoj vseruskega testa iz kemije. Namen vzorčnega testnega dela je dati idejo o strukturi vseruskega testnega dela, številu in obliki nalog ter njihovi stopnji zahtevnosti.
VPR. kemija. Šifra 11. razreda
© 2017 Zvezna služba za nadzor v izobraževanju in znanosti Ruske federacije VSERUSKO TESTIRANJE DELA KEMIJA
11. RAZRED VZOREC Navodila za izdelavo testa Testno delo obsega 15 nalog. Za izvedbo dela pri kemiji je predvidena 1 ura 30 minut (90 minut) Odgovore vpišite v besedilo naloge po navodilih za naloge Če zapišete napačen odgovor, ga prečrtajte in vpišite novega Ob zaključku dela je dovoljena uporaba naslednjih dodatnih materialov
– Periodni sistem kemijskih elementov D.I. Mendelejev
– tabela topnosti soli, kislin in baz z uvedbo elektrokemijskega niza kovinskih napetosti
– neprogramabilni kalkulator. Pri izpolnjevanju nalog lahko uporabite osnutek. Vnosi v osnutku ne bodo pregledani ali ocenjeni. Svetujemo vam, da naloge opravljate v vrstnem redu, kot so podane. Če želite prihraniti čas, preskočite nalogo, ki je ne morete dokončati takoj, in nadaljujte z naslednjo. Če vam po opravljenem delu ostane čas, se lahko vrnete k zamujenim opravilom. Točke, ki jih prejmete za opravljene naloge, se seštejejo. Poskusite opraviti čim več nalog in doseči največ točk. Želimo vam uspeh
VPR. kemija. Šifra 11. razreda
© 2017 Zvezna služba za nadzor izobraževanja in znanosti Ruske federacije Iz vašega tečaja kemije poznate naslednje metode za ločevanje zmesi: sedimentacija, filtracija, destilacija (destilacija, magnetno delovanje, izhlapevanje, kristalizacija. Slike 1–3 prikazujejo primere uporaba nekaterih od teh metod Slika 1 Slika 2 Slika 3
Katero od naslednjih metod za ločevanje zmesi lahko uporabimo za čiščenje?
1) moka iz ujetih železnih opilkov
2) voda iz v njej raztopljenih anorganskih soli V tabelo zapišite številko slike in ime ustreznega načina ločevanja mešanice. Zmes Številka slike Način ločevanja zmesi Moka in ujeti železovi opilki Voda z raztopljenimi anorganskimi solmi Slika prikazuje model elektronske zgradbe atoma določenega kemičnega elementa. Na podlagi analize predlaganega modela rešite naslednje naloge) določite kemijski element, katerega atom ima takšno elektronsko strukturo
2) navedite številko obdobja in številko skupine v periodnem sistemu kemijskih elementov D.I. Mendelejeva, v katerem se nahaja ta element
3) ugotovite, ali je preprosta snov, ki tvori ta kemični element, kovina ali nekovina. Odgovore zapiši v tabelo. Odgovor Simbol kemičnega elementa
Obdobje št.
Št. skupine Kovinski nekovin
1
2
VPR. kemija. Šifra 11. razreda
© 2017 Zvezna služba za nadzor v izobraževanju in znanosti Ruske federacije Periodni sistem kemijskih elementov D.I. Mendelejev je bogato skladišče informacij o kemičnih elementih, njihovih lastnostih in lastnostih njihovih spojin, vzorcih sprememb teh lastnosti, načinih pridobivanja snovi in njihovi lokaciji v naravi. Na primer, znano je, da se s povečanjem atomskega števila kemičnega elementa v obdobjih polmeri atomov zmanjšajo, v skupinah pa se povečajo. Ob upoštevanju teh zakonitosti razporedite naslednje elemente po naraščajočih atomskih polmerih: N, C, Al, Si. Zapišite oznake elementov v zahtevanem zaporedju. Odgovor __________________________ V spodnji tabeli so navedene značilne lastnosti snovi, ki imajo molekularno in ionsko zgradbo. Značilne lastnosti snovi Molekularna struktura Ionska zgradba v normalnih pogojih imajo tekoče, plinasto in trdno agregatno stanje imajo nizko vrelišče in tališče
niso električno prevodni; imajo nizko toplotno prevodnost
trdno pri normalnih pogojih, krhko, ognjevzdržno, nehlapno v talinah in raztopinah prevaja električni tok.S tem podatkom ugotovi, kakšno zgradbo imata snovi dušik in kuhinjska sol NaCl. Odgovor zapiši v za to namenjen prostor.
1) dušik N
2
________________________________________________________________
2) kuhinjska sol NaCl ____________________________________________________
3
4
VPR. kemija. Šifra 11. razreda
© 2017 Zvezna služba za nadzor v izobraževanju in znanosti Ruske federacije Kompleksne anorganske snovi lahko pogojno razdelimo, torej razvrstimo v štiri skupine, kot je prikazano na diagramu. V tem diagramu za vsako od štirih skupin vpišite imena manjkajočih skupin ali kemijske formule snovi (en primer formul, ki spadajo v to skupino. Preberite naslednje besedilo in dokončajte naloge 6–8. Živilska industrija uporablja aditiv za živila E, ki je kalcijev hidroksid Ca(OH)
2
. Uporablja se pri proizvodnji sadnih sokov, otroške hrane, vloženih kumaric, kuhinjske soli, slaščic in slaščic. Kalcijev hidroksid je mogoče proizvesti v industrijskem obsegu z mešanjem kalcijevega oksida z vodo, proces, imenovan kaljenje. Kalcijev hidroksid se pogosto uporablja pri proizvodnji gradbenih materialov, kot so belilo, omet in mavčne malte. To je posledica sposobnosti interakcije z ogljikovim dioksidom CO
2
vsebovan v zraku. Ista lastnost raztopine kalcijevega hidroksida se uporablja za merjenje količinske vsebnosti ogljikovega dioksida v zraku. Uporabna lastnost kalcijevega hidroksida je njegova sposobnost, da deluje kot flokulant, ki čisti odpadno vodo iz suspendiranih in koloidnih delcev (vključno z železovimi solmi. Uporablja se tudi za zvišanje pH vode, saj naravna voda vsebuje snovi (npr. kisline, ki povzročajo korozija v vodovodnih napeljavah).cevi
5
VPR. kemija. Šifra 11. razreda
© 2017 Zvezna služba za nadzor v izobraževanju in znanosti Ruske federacije
6 1. Napišite molekulsko enačbo reakcije, pri kateri nastane kalcijev hidroksid, ki je omenjen v besedilu. Odgovori
2. Pojasnite, zakaj se ta proces imenuje kaljenje. Odgovori
________________________________________________________________________________
1. Napišite molekulsko enačbo reakcije med kalcijevim hidroksidom in ogljikovim dioksidom, ki je omenjena v besedilu. Odgovori
2. Pojasnite, katere značilnosti te reakcije omogočajo uporabo za zaznavanje ogljikovega dioksida v zraku. Odgovori
________________________________________________________________________________
________________________________________________________________________________
1. Napiši skrajšano ionsko enačbo za v besedilu omenjeno reakcijo med kalcijevim hidroksidom in klorovodikovo kislino. Odgovori
2. Pojasnite, zakaj se ta reakcija uporablja za povečanje pH vode. Odgovori
________________________________________________________________________________
________________________________________________________________________________
6
7
8
VPR. kemija. Šifra 11. razreda
© 2017 Zvezna služba za nadzor v izobraževanju in znanosti Ruske federacije Podana je shema redoks reakcije.
H
2
S + Fe
2
O
3
→ FeS + S + H
2
O
1. Naredite elektronsko tehtnico za to reakcijo. Odgovori
2. Določite oksidant in reducent. Odgovori
3. Razporedi koeficiente v enačbi reakcije. Odgovor Shema transformacije je podana
Fe Napišite enačbe molekulskih reakcij, s katerimi lahko izvedete navedene transformacije.
1) _________________________________________________________________________
2) _________________________________________________________________________
3) ________________________________________________________________________________ Vzpostavite ujemanje med formulo organske snovi in razredom/skupino, v katero ta snov spada, za vsako mesto, označeno s črko, izberite ustrezno mesto, označeno s številko. FORMULA SNOVI
RAZRED/SKUPINA A)
CH
3
-CH
2
-CH
3
B) C)
CH
3
-CH
2
OH
1) nasičeni ogljikovodiki
2) alkoholi
3) nenasičeni ogljikovodiki
4) karboksilne kisline Izbrane številke zapiši v tabelo pod ustrezne črke. A B C Odgovor
9
10
11
VPR. kemija. Šifra 11. razreda
© 2017 Zvezna služba za nadzor v izobraževanju in znanosti Ruske federacije V predlagane sheme kemijskih reakcij vstavite formule manjkajočih snovi in uredite koeficiente.
1) C
2
n
6
+ ……………… → C
2
n
5
Cl+HCl
2)C
3
H
6
+ ……………… → CO
2
+H
2
O Propan gori z nizkimi stopnjami strupenih emisij v ozračje, zato se uporablja kot vir energije v številnih aplikacijah, kot so plinski vžigalniki in ogrevanje doma. Kolikšna prostornina ogljikovega dioksida nastane pri popolnem zgorevanju 4,4 g propana? Zapiši podrobno rešitev naloge. Odgovori
________________________________________________________________________________
______________________________________________________________________________ Izopropilni alkohol se uporablja kot univerzalno topilo, vključen je v gospodinjske kemikalije, parfume in kozmetiko ter tekočine za pranje vetrobranskega stekla v avtomobilih. V skladu s spodnjim diagramom sestavite reakcijske enačbe za proizvodnjo tega alkohola. Pri pisanju reakcijskih enačb uporabljajte strukturne formule organskih snovi.
CH
2
CH CH
3
CH
3
CCH
3
O
CH
3
CH CH
3
Br
CH
3
CH
CH
3
OH
1) _______________________________________________________
2) _______________________________________________________
3) _______________________________________________________
12
13
14
VPR. kemija. Šifra 11. razreda
© 2017 Zvezna služba za nadzor izobraževanja in znanosti Ruske federacije Fiziološka raztopina v medicini je 0,9% raztopina natrijevega klorida v vodi. Izračunajte maso natrijevega klorida in maso vode, potrebne za pripravo
500 g fiziološke raztopine. Zapišite podrobno rešitev problema. Odgovori
________________________________________________________________________________
________________________________________________________________________________
15
VLOOKUP
. kemija. 11. razred. Odgovori 2017 Zvezna služba za nadzor v izobraževanju in znanosti Ruske federacije VSERUSKO INŠPEKCIJSKO DELO
KEMIJA
, 11
RAZRED
Odgovori
ety
in merila za ocenjevanje
ania
№
naloge
Odgovori
št
1
Mešanica
številka
risanje
Pot
ločitev
mešanice
Moka in ujeti železni opilki Magnetno delovanje
Voda z anorganskimi solmi, raztopljenimi v njej
Destilacija
(destilacija
2
N; 2; 5 (ali V); nekovin N
→
C
→
Si
→
Al
4 dušik N
2
– molekularna zgradba kuhinjske soli NaCl – ionska zgradba 132 Pravilen odgovor pri nalogi 3 se ocenjuje z eno točko.
Izpolnjevanje nalog 1, 2, 4, 11 se ocenjuje na naslednji način: 2 točki - brez napak.
1 točka – storjena je bila ena napaka 0 točk – storjeni sta bili dve ali več napak ali ni bilo odgovora
Vsebina
pravilen odgovor in navodila za ocenjevanje
n
Iyu
Točke
Elementi odgovora. Zapisana so imena skupin baz in soli, zapisane so formule snovi ustreznih skupin.
Odgovor je pravilen in popoln, vsebuje vse zgoraj navedene elemente Tri celice diagrama so pravilno izpolnjene 1 Storjeni sta bili dve ali več napak Najvišje število točk.
5
VLOOKUP
. kemija. 11. razred. Odgovori 2017 Zvezna služba za nadzor v izobraževanju in znanosti Ruske federacije Vsebina pravilnega odgovora in navodila za ocenjevanje
n
Iyu
(Poleg tega poiščite druge formulacije odgovora, ki ne izkrivljajo njegovega pomena
Točke
Elementi odziva
1) CaO + H
2
O = Ca(
OH)
2 2) Pri interakciji kalcijevega oksida z vodo se sprosti velika količina toplote, zato voda vre in sika, kot bi zadela vroč premog, ko ogenj ugasnemo z vodo (
oz
»Ta postopek imenujemo gašenje, ker posledično nastane gašeno apno
»)
Odgovor je pravilen in popoln, vsebuje vse zgoraj navedene elemente Odgovor vsebuje enega od zgornjih elementov 1 Vsi elementi odgovora so napačno zapisani 0 Največja ocena 2 Vsebina pravilnega odgovora in navodila za točkovanje
n
Iyu
(Poleg tega poiščite druge formulacije odgovora, ki ne izkrivljajo njegovega pomena
Točke
Elementi odziva
1) Ca(OH)
2
+ CO
2
= CaCO
3
↓+H
2
O
2) Kot rezultat te reakcije nastane netopna snov, kalcijev karbonat, opazimo motnost prvotne raztopine, kar nam omogoča presojo prisotnosti ogljikovega dioksida v zraku.Kvalitativna reakcija na Odgovor je pravilen in popoln, vsebuje vse zgoraj navedene elemente Odgovor vsebuje enega od zgornjih elementov 1 Vsi elementi odgovori napačno zapisani 0 Največja ocena 2 Vsebina pravilnega odgovora in navodila za točkovanje
n
Iyu
(Poleg tega poiščite druge formulacije odgovora, ki ne izkrivljajo njegovega pomena
Točke
Elementi odziva
1) OH
–
+H
+
=H
2
O
2) Prisotnost kisline v naravni vodi povzroča nizke vrednosti te vode
Kalcijev hidroksid
nevtralizirati
št
kislo
otu
, vrednosti pa naraščajo Odgovor je pravilen in popoln, vsebuje vse zgornje elemente Odgovor vsebuje enega od zgornjih elementov 1 Vsi elementi odgovora so napačno zapisani 0 Najvišja ocena 2
6
7
8
VLOOKUP
n
Iyu
(Poleg tega poiščite druge formulacije odgovora, ki ne izkrivljajo njegovega pomena
Točke
1) Sestavljena je bila elektronska bilanca) Označeno je, da je žveplo v oksidacijskem stanju –2 (ali H
2
S) je redukcijsko sredstvo, železo pa je v oksidacijskem stanju +3 ali Fe
2
O
3
) – oksidant
3) Reakcijska enačba je bila sestavljena
3H
2
S + Fe
2
O
3
= 2FeS + S + 3
H
2
O Odgovor je pravilen in popoln, vsebuje vse zgoraj navedene elemente odgovora Dva od zgoraj navedenih elementov odgovora sta pravilno zapisana 2 Eden od zgoraj navedenih elementov odgovora je zapisan pravilno 1 Vsi elementi odgovora odgovor je napisan napačno 0 Najvišje število točk Vsebina pravilnega odgovora in navodila za ocenjevanje
n
Iyu
Točke
Napisane so reakcijske enačbe, ki ustrezajo transformacijski shemi
1) Fe + 2HCl = FeCl
2
+H
2 2) FeCl
2
+ 2AgNO
3
= Fe(NO
3
2
+ 2Ag
C
l
3) Fe (NO
3
2
+ 2KOH = F
e(OH)
2
.)
n
Iyu
Točke
Elementi odziva
1)
Z
2
n
6
+ Cl
2
→
Z
2
n
5
Cl+HCl
2) 2C
3
H
6
+ 9O
2
→
6C
O
2
+ 6
H
2
O Možni so delni koeficienti) Odgovor je pravilen in popoln, vsebuje vse zgornje elemente V enem od elementov odgovora je bila storjena napaka 1 Vsi elementi odgovora so napačno zapisani 0 Najvišja ocena
9
10
12
VLOOKUP
. kemija. 11. razred. Odgovori 2017 Zvezna služba za nadzor v izobraževanju in znanosti Ruske federacije Vsebina pravilnega odgovora in navodila za ocenjevanje
n
Iyu
(Poleg tega poiščite druge formulacije odgovora, ki ne izkrivljajo njegovega pomena
Točke
1) Enačba za reakcijo zgorevanja propana je bila sestavljena
Z
3
n
8
+ O →
CO + HO) n(
Z
3
n
8
) = 4,4/44 = 0,1 mol SOCH mol) O) = 0,3 · 22,4 = 6,72 l Odgovor je pravilen in popoln, vsebuje vse zgornje elemente, dva od zgornjih elementov odgovora sta zapisana pravilno 2 Popravi enega od zgornjih elementi odgovora so zapisani 1 Vsi elementi odgovora so napačno zapisani 0 Najvišje število točk 3 Vsebina pravilnega odgovora in navodila za točkovanje
n
Iyu
Točke
Napisane so reakcijske enačbe, ki ustrezajo diagramu
1)
C
H
3
CH
CH
2
+H
2
O
H
2
SO
4
, t
°
CH
3
CH
CH
3
OH
CH
3
CC
H
3
O
+ mačka + voda n. r-r,
t
°
+ Druge reakcijske enačbe, ki niso v nasprotju s pogoji za določitev reakcijskih enačb, so dovoljene
.)
Tri reakcijske enačbe so pravilno napisane Dve reakcijski enačbi sta pravilno napisani 2 Ena reakcijska enačba je pravilno napisana 1 Vse enačbe so napačno napisane oziroma ni odgovora 0 Najvišje število točk Vsebina pravilnega odgovora in navodila za točkovanje
n
Iyu
(Poleg tega poiščite druge formulacije odgovora, ki ne izkrivljajo njegovega pomena
Točke
Elementi odziva
1)m
(NaCl) = 4,5 g
2) voda) = 495,5 g
Odgovor je pravilen in popoln, vsebuje vse zgoraj navedene elemente Odgovor vsebuje enega od zgornjih elementov 1 Vsi elementi odgovora so zapisani nepravilno 0 Najvišja ocena 2
13
14
15
Vse-rusko testno delo VPR Vse-rusko testno delo - Kemija 11. razred
Pojasnila za vzorec vseruskega testnega dela
Ko se seznanite z vzorčnim preizkusnim delom, ne pozabite, da naloge, vključene v vzorec, ne odražajo vseh spretnosti in vsebinskih vprašanj, ki bodo preizkušena v okviru vseruskega testnega dela. Popoln seznam vsebinskih elementov in veščin, ki jih je mogoče preizkusiti pri delu, je naveden v kodifikatorju vsebinskih elementov in zahtev za stopnjo usposobljenosti diplomantov za razvoj vseruskega testa iz kemije. Namen vzorčnega testnega dela je dati idejo o strukturi vseruskega testnega dela, številu in obliki nalog ter njihovi stopnji zahtevnosti.
Navodila za izvedbo dela
Test obsega 15 nalog. Za dokončanje kemijskega dela je na voljo 1 ura 30 minut (90 minut).
Svoje odgovore oblikujte v besedilu dela v skladu z navodili za naloge. Če zapišete napačen odgovor, ga prečrtajte in zraven napišite novega.
Pri opravljanju dela je dovoljeno uporabljati naslednje dodatne materiale:
– Periodni sistem kemijskih elementov D.I. Mendelejev;
– tabela topnosti soli, kislin in baz v vodi;
– elektrokemijske serije kovinskih napetosti;
– neprogramabilni kalkulator.
Pri izpolnjevanju nalog lahko uporabite osnutek. Vnosi v osnutku ne bodo pregledani ali ocenjeni.
Svetujemo vam, da naloge opravljate v vrstnem redu, kot so podane. Če želite prihraniti čas, preskočite nalogo, ki je ne morete dokončati takoj, in nadaljujte z naslednjo. Če vam po opravljenem delu ostane čas, se lahko vrnete k zamujenim opravilom.
Točke, ki jih prejmete za opravljene naloge, se seštejejo. Poskusite opraviti čim več nalog in doseči največ točk.
Želimo vam uspeh!
1. Iz vašega predmeta kemije poznate naslednje metode za ločevanje zmesi: usedanje, filtracija, destilacija (destilacija), magnetno delovanje, izhlapevanje, kristalizacija. Na slikah 1–3 so prikazani primeri uporabe nekaterih od naštetih metod.
Katero od naslednjih metod za ločevanje zmesi je mogoče uporabiti za čiščenje:
1) moka iz železnih opilkov, ki so prišli vanjo;
2) voda iz v njej raztopljenih anorganskih soli?
V tabelo zapiši številko slike in naziv ustreznega načina ločevanja zmesi.
železne opilke privlači magnet
Med destilacijo po kondenzaciji vodne pare v posodi ostanejo kristali soli
2. Slika prikazuje model elektronske strukture atoma neke kemikalijeelement.

Na podlagi analize predlaganega modela opravite naslednje naloge:
1) identificirati kemični element, katerega atom ima takšno elektronsko strukturo;
2) navedite številko obdobja in številko skupine v periodnem sistemu kemijskih elementov D.I. Mendelejev, v katerem se nahaja ta element;
3) ugotovite, ali je preprosta snov, ki tvori ta kemični element, kovina ali nekovina.
Odgovore zapiši v tabelo.
odgovor:
N; 2; 5 (ali V); nekovinsko
za določitev kemijskega elementa bi morali prešteti skupno število elektronov, ki jih vidimo na sliki (7)
če upoštevamo periodni sistem, zlahka določimo element (število najdenih elektronov je enako atomskemu številu elementa) (N-dušik)
po tem določimo številko skupine (navpični stolpec) (5) in naravo tega elementa (nekovinski)
3. Periodni sistem kemijskih elementov D.I. Mendelejev– bogato skladišče informacij o kemijskih elementih, njihovih lastnostih in lastnostih njihovih spojin, o vzorcih spreminjanja teh lastnosti, o načinih pridobivanja snovi, pa tudi o njihovi legi v naravi. Na primer, znano je, da se s povečanjem atomskega števila kemičnega elementa v obdobjih polmeri atomov zmanjšajo, v skupinah pa se povečajo.
Ob upoštevanju teh vzorcev razporedite naslednje elemente po naraščajočih atomskih polmerih: N, C, Al, Si. Zapišite oznake elementov v zahtevanem zaporedju.
Odgovor: __________________________
N → C → Si → Al
4. V spodnji tabeli so navedene značilne lastnosti snovi, ki imajo molekularno in ionsko zgradbo.
S pomočjo teh podatkov ugotovi, kakšno zgradbo imata snovi dušik N2 in kuhinjska sol NaCl. Odgovor zapiši v predviden prostor:
1) dušik N2 ________________________________________________________________
2) kuhinjska sol NaCl ____________________________________________________
dušik N2 – molekularna struktura;
kuhinjska sol NaCl – ionska struktura
5. Kompleksne anorganske snovi lahko pogojno razdelimo, torej razvrstimo v štiri skupine, kot prikazuje diagram. V ta diagram za vsako od štirih skupin vpišite manjkajoča imena skupin ali kemijske formule snovi (en primer formul), ki pripadajo tej skupini.

Zapišemo imena skupin: baze, soli;
zapisane so formule snovi ustreznih skupin
CaO, baze, HCl, soli
Preberite naslednje besedilo in dokončajte naloge 6–8.
Živilska industrija uporablja aditiv za živila E526, ki je kalcijev hidroksid Ca(OH)2. Uporablja se pri proizvodnji: sadnih sokov, otroške hrane, vloženih kumaric, kuhinjske soli, slaščic in slaščic.
Kalcijev hidroksid je mogoče proizvesti v industrijskem obsegu z mešanjem kalcijevega oksida z vodo, se ta proces imenuje kaljenje.
Kalcijev hidroksid se pogosto uporablja pri proizvodnji gradbenih materialov, kot so belilo, omet in mavčne malte. To je posledica njegove sposobnosti medsebojno delujejo z ogljikovim dioksidom CO2 vsebovan v zraku. Ista lastnost raztopine kalcijevega hidroksida se uporablja za merjenje količinske vsebnosti ogljikovega dioksida v zraku.
Uporabna lastnost kalcijevega hidroksida je njegova sposobnost, da deluje kot flokulant, ki čisti odpadno vodo iz suspendiranih in koloidnih delcev (vključno z železovimi solmi). Uporablja se tudi za zvišanje pH vode, saj naravna voda vsebuje snovi (npr. kisline), kar povzroča korozijo v vodovodnih ceveh.
1. Napišite molekularno enačbo za reakcijo, pri kateri nastane kalcijev hidroksid, ki
omenjeno v besedilu.
2. Pojasnite, zakaj se ta proces imenuje kaljenje.
Odgovor: ________________________________________________________________________________
________________________________________________________________________________
1) CaO + H 2 O = Ca(OH) 2
2) Ko kalcijev oksid medsebojno deluje z vodo, se sprosti velika količina
količino toplote, zato voda vre in sika, kot da bi zadela razgret premog, ko ogenj ugasnemo z vodo (oz. »ta proces imenujemo gašenje, ker pri tem nastane gašeno apno«)
1. Napišite molekularno enačbo reakcije med kalcijevim hidroksidom in ogljikovim dioksidom
plin, ki je bil omenjen v besedilu.
Odgovor: ________________________________________________________________________________
2. Pojasnite, katere značilnosti te reakcije omogočajo njeno uporabo za detekcijo
ogljikov dioksid v zraku.
Odgovor: ________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O
2) Kot rezultat te reakcije nastane netopna snov - kalcijev karbonat, opazimo motnost prvotne raztopine, kar nam omogoča presojo prisotnosti ogljikovega dioksida v zraku (kvalitativno
reakcija na CO 2)
1. Napišite skrajšano ionsko enačbo za v besedilu omenjeno reakcijo med
kalcijev hidroksid in klorovodikova kislina.
Odgovor: ________________________________________________________________________________
2. Pojasnite, zakaj se ta reakcija uporablja za povečanje pH vode.
Odgovor: ________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) OH – + H + = H 2 O (Ca(OH)2+ 2HCl = CaCl2 + 2H2O)
2) Prisotnost kisline v naravni vodi povzroča nizke vrednosti pH te vode. Kalcijev hidroksid nevtralizira kislino in pH vrednosti se zvišajo
Lestvica pH obstaja od 0-14. od 0-6 – kislo okolje, 7 – nevtralno okolje, 8-14 – alkalno okolje
9. Podan je diagram redoks reakcije.
H 2 S + Fe 2 O 3 → FeS + S + H 2 O
1. Naredite elektronsko tehtnico za to reakcijo.
Odgovor: ________________________________________________________________________________
2. Določite oksidant in reducent.
Odgovor: ________________________________________________________________________________
3. Razporedi koeficiente v enačbi reakcije.
Odgovor: ________________________________________________________________________________
1) Sestavljena je elektronska bilanca:
| 2Fe +3 + 2ē → 2Fe +2 | 2 | 1 | |
| 2 | |||
| S -2 – 2ē → S 0 | 2 | 1 |
2) Označeno je, da je žveplo v oksidacijskem stanju –2 (ali H 2 S) redukcijsko sredstvo, železo v oksidacijskem stanju +3 (ali Fe 2 O 3) pa je oksidacijsko sredstvo;
3) Reakcijska enačba je sestavljena:
3H 2 S + Fe 2 O 3 = 2FeS + S + 3H 2 O
10. Shema transformacije je podana:
Fe → FeCl 2 → Fe(NO 3) 2 → Fe(OH) 2
Napišite molekularne enačbe reakcij, ki jih je mogoče uporabiti za izvedbo
navedene transformacije.
1) _________________________________________________________________________
2) _________________________________________________________________________
3) _________________________________________________________________________
Reakcijske enačbe, ki ustrezajo transformacijski shemi, so zapisane:
1) Fe + 2HCl = FeCl 2 + H 2
2) FeCl 2 + 2AgNO 3 = Fe(NO 3) 2 + 2AgCl
3) Fe(NO 3) 2 + 2KOH = Fe(OH) 2 + 2KNO 3
(Dovoljene so druge enačbe, ki niso v nasprotju s pogoji za določanje enačb
reakcije.)
11. Vzpostavite ujemanje med formulo organske snovi in razredom/skupino, ki ji ta snov pripada: za vsako mesto, označeno s črko, izberite ustrezno mesto, označeno s številko.
Izbrane številke zapišite v tabelo pod pripadajoče črke.
odgovor:
| A | B | IN |
- C3H8 – CnH2n+2 – alkan
- C3H6 – CnH2n-alken
- C2H6O – CnH2n+2O- alkohol
12. V predlagane sheme kemijskih reakcij vstavi formule manjkajočih snovi in razporedi koeficiente.
1) C 2 H 6 + …………….. → C 2 H 5 Cl + HCl
2) C 3 H 6 + …………….. → CO 2 + H 2 O
1) C 2 H 6 + Cl 2 → C 2 H 5 Cl + HCl
2) 2C 3 H 6 + 9O 2 → 6CO 2 + 6H 2 O
(Možne so delne kvote.)
13. Propan gori z nizkimi stopnjami strupenih emisij v ozračje Zato se uporablja kot vir energije na številnih področjih, na primer v plinskih vžigalnikih in za ogrevanje podeželskih hiš.
Kakšna prostornina ogljikovega dioksida (CO) nastane, ko 4,4 g propana popolnoma zgori?
Zapišite podrobno rešitev problema.
Odgovor: ________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Enačba za reakcijo zgorevanja propana je bila sestavljena:
C 3 H 8 + 5 O 2 → 3 CO 2 + 4 H 2 O
2) n(C3H8) = 4,4/44 = 0,1 mol
n(CO 2) = 3n (C 3 H 8) = 0,3 mol
3) V(O 2) = 0,3 22,4 = 6,72 l
14. Izopropilni alkohol se uporablja kot univerzalno topilo: vključen je v gospodinjske kemikalije, parfume in kozmetiko ter tekočine za pranje vetrobranskega stekla za avtomobile. V skladu s spodnjim diagramom sestavite reakcijske enačbe za proizvodnjo tega alkohola. Pri pisanju reakcijskih enačb uporabljajte strukturne formule organskih snovi.

1) _______________________________________________________
2) _______________________________________________________
3) _______________________________________________________
Reakcijske enačbe, ki ustrezajo shemi, so zapisane:

(Dovoljene so druge reakcijske enačbe, ki niso v nasprotju s pogoji za določanje reakcijskih enačb.)
15. V medicini je fiziološka raztopina 0,9 % raztopina natrijevega klorida v vodi. Izračunajte maso natrijevega klorida in maso vode, potrebnih za pripravo 500 g fiziološke raztopine. Zapišite podrobno rešitev problema.
Odgovor: ________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) m(NaCl) = 4,5 g
2) m(voda) = 495,5 g
m(raztopina) = 500g m(sol) = x
x/500 * 100 %= 0,9 %
m(sol) = 500* (0,9/100)= 4,5 g
© 2017 Zvezna služba za nadzor v izobraževanju in znanosti Ruske federacije